PARA DESCARGAR EL ARCHIVO ORIGINAL:
Click aquí
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 °
TEMa: LAS SOLUCIONES n° 2
( HACER TODO EN EL CARTAPACIO DE QUÍMICA)
(PARA LOS CÁLCULOS RECORDAR QUE LA DENSIDAD DEL AGUA ES: 1.00 g H2O / 1.00 mL H2O)
I PARTE. A continuación se presentarán a determinadas temperaturas, las MÁXIMAS Solubilidades de ciertos solutos por cada 100 gramos de Agua. Considere cada uno de los 5 EVENTOS que se presentan y llene el CUADRO adjunto con la información requerida. Tipo de Solución ( No Saturada, Saturada y Sobresaturada); Equilibrio Dinámico ( Use (+) para Mayor, (–) para Menor, (=) para igual ).
1- Solubilidad del Cloruro de sodio a 20 ºC: 36 g sal binaria / 100 g Agua. A 20 ºC una persona disuelve 25 g de la sal binaria en 100 gramos de agua.
2- Solubilidad del Cloruro de potasio a 20 ºC: 34 g sal binaria / 100 g Agua. A 20 ºC en el laboratorio de Química, un estudiante mezcla 50 g de la sal binaria en 100 mL de agua. ( NOTA: Se obtiene Precipitado. Para evaluar el Tipo de Solución considere solamente la solución líquida sobrenadante (arriba del precipitado) ).
3- Solubilidad del Fosfato de sodio a 140 ºF: 50 g oxosal / 100 g Agua. A 302 ºF un estudiante disuelve completamente 100 g de la oxosal en 100 gramos de agua. ( NOTA: NO Se obtiene precipitado)
4- Solubilidad del Trinitrato (V) de sodio a 50 ºC: 114 g oxosal / 100 g Agua. A 50 ºC una persona disuelve 228 g de la oxosal en 0.20 L de agua.
5- Solubilidad del Yoduro de potasio a 313 ºK: 156 g sal binaria / 100 g Agua. A 313 ºK una persona prepara una solución disolviendo 0.10 Kg de la sal binaria en 100 mL de agua.
EVENTO Nº TIPO DE SOLUCIÓN VELOC. DISOLUCIÓN VELOC. CRISTALIZACIÓN
1
2
3
4
5
II PARTE. Responda a las siguientes preguntas basados en los eventos planteados en la I PARTE.
evento nº 1
a) Si en este evento la temperatura del agua aumenta desde 20 ºC hasta 40 ºC; la Velocidad de Disolución de los 25 g de Cloruro de sodio en agua ; ¿ Aumentaría o disminuiría ?
b) Si la temperatura disminuye desde 20 ºC hasta 10 ºC; ¿ Se podrían disolver completamente en agua los 25 g de Cloruro de sodio? Sí / No. ¿Por qué?
evento nº 2
a) A una temperatura de 20 ºC; ¿ Cuántos gramos de los 50 g de Cloruro de potasio se disolverán completamente en agua ?.
b) A una temperatura de 20 ºC; ¿ Cuántos gramos de los 50 g de Cloruro de potasio se depositarían en el fondo del recipiente (Precipitado) en donde esté la solución acuosa de la sal binaria ?.
c) A una temperatura de 20 ºC; si AUMENTAMOS la PRESIÓN a la que se encuentra el sistema de Solución KCl / H2O,
¿Se beneficiaría la velocidad de disolución de la sal binaria (KCl) en agua ?. Sí / No. ¿Por qué?
evento nº 3
a) ¿ Qué ocurriría con los 100 gramos de Fosfato de sodio una vez la temperatura disminuya desde 302 ºF hasta 140 ºF ?
¿Aumentaría su disolución en agua ?¿Precipitaría toda la masa de la oxosal ? ¿ Precipitaría una parte de la masa ?
b) ¿ Cuántos gramos de Fosfato de sodio permanecerá en solución a 140 ºF ?.
c) ¿ Cuántos gramos de Fosfato de sodio precipitarían hacia el fondo del recipiente a 140 ºF ?.
evento nº 4
a) A 50 ºC; ¿ Cuántos gramos de agua se requieren para disolver 342 g de Trinitrato (V) de sodio y mantener el mismo tipo de solución que usted evaluó en el cuadro ?.
b) A 50 ºC; ¿ Cuántos gramos de Trinitrato (V) se pueden disolver en 1.00 L de agua y mantener el mismo tipo de solución que usted evaluó en el cuadro ?.
c) A una temperatura de 50 ºC; si DISMINUÍMOS la PRESIÓN a la que se encuentra el sistema de Solución KCl / H2O,
¿Se beneficiaría la velocidad de disolución de la sal binaria (KCl) en agua ?. Sí / No. ¿Por qué?
evento nº 5
a) Si en este evento la temperatura del agua decrece desde 313 ºK hasta 293 ºK; ¿ Qué ocurriría con la Velocidad de Cristalización de los 0.10 Kg del Yoduro de potasio en los 100 mL de agua ? ¿Aumentaría o disminuiría ?
b) A una temperatura de 40 ºC; ¿Cuántos gramos de los 0.10 Kg de KI se disuelve como Máximo en los 100 mL de agua ?
b) A una temperatura de 313 ºK; ¿Cuántos gramos le hacen falta a los 0.10 Kg de KI para alcanzar el LÍMITE DE SOLUBILIDAD del KI en agua ?.
III PARTE. A continuación se presentarán diversos eventos de solubilidad de gases en líquidos a determinadas condiciones de temperatura y presión. Considere cada uno de los EVENTOS que se presentan y llene el CUADRO adjunto con la información requerida.
Densidad del gas (Soluto) ( Use (+) para Alta; (–) para Baja ). Volumen del gas ( Use (+) para Aumentó, (–) para Disminuyó ). Solubilidad del gas ( Use (+) para Aumenta; (–) para Disminuye )
1- Una pareja de recién casados celebran su luna de miel solicitando al hotel donde se hospedan una Champaña helada.
Cuando reciben el pedido, por error del camarero, les entregan la botella de Champaña ya descorchada (destapada) y a temperatura ambiente (sin haberla enfriado previamente). Cuando la pareja prueba la Champaña la sienten insípida.
2- Un estudiante de 12º del Colegio, abre a la hora del RECREO, una lata de Soda BIEN Fría y el líquido NO brota con espuma desde dentro de la lata.
3- Los buzos emplean para respirar, en sus rutinas, tanques de Aire comprimido (mezcla gaseosa de Nitrógeno- Oxígeno). Conforme el buzo se sumerge a grandes profundidades marinas los gases respirados pasan a dispersarse completamente en la sangre.
4- En un lago situado a 5500 m de altura sobre el nivel del mar, encontramos menos Oxígeno, que si el lago estuviera a nivel del mar.
5- El mal olor provocado por una flatulencia (producto de dietas alimenticias ricas en azufre), se percibe más fuerte en un salón de clases con el aire acondicionado dañado. NOTA: El gas flatulento actúa como soluto / El aire del medio es el solvente.
EVENTO Nº DENSID. GAS (SOLUTO) VOLUMEN DEL GAS SOLUBILIDAD DEL GAS
1
2
3
4
5
IV PARTE. Justifique o Cuestione, con una explicación basada en los temas tratados en clases, los siguientes enunciados.
1- Una bolita blanca de Naftaleno (C10 H8) que sirve para las polillas, se disuelve más rápido en Tetracloruro de carbono (CCl4), que si intentamos disolver el Naftaleno en forma triturada (machacado).
2- La Sacarosa o azúcar de mesa (C12H22O11) se disuelve lentamente si endulzamos (empleando una cucharada) un Té que contiene cubitos de hielo, que otro Té que está tibio.
3- Una solución acuosa que tiene Precipitado (sólido en el fondo del recipiente que la contiene) es considerada: “ Una Solución Sobresaturada ”.
4- A nivel del mar la Presión atmosférica es de 1.00 Atmósferas ó 760 Torr. Si ascendemos hasta la cima de una montaña que está a 8000 m por encima del nivel del mar y allá arriba destapamos una lata de soda; entonces se observaría que el líquido de la soda brotaría con más espuma que si abriéramos la lata de soda a nivel del mar.
5- Cuando los buzos ascienden desde las profundidades marinas deben hacerlo calmadamente (muy lento) para que los gases disueltos en la sangre sean eliminados vía pulmonar. Si emergen a la superficie muy rápido los gases disueltos en la sangre formarían burbujas que causarían obstrucción de los vasos sanguíneos provocando derrames cerebrales.
(Investigar Aeroembolismos).
6- La sal sólida Nitrato de potasio (KNO3) se disuelve más rápidamente en agua si AUMENTAMOS la PRESIÓN al disolver el KNO3 / H2O.
7- Una solución SATURADA contiene el soluto disuelto en el “LIMITE DE SOLUBILIDAD”.
Páginas
CADA Trabajo tiene un link de descarga al principio o al final del contenido
sábado, 27 de marzo de 2010
jueves, 18 de marzo de 2010
LAS SOLUCIONES n° 1
Para Descargar el archivo original
Click aquí
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 °
TEMA: LAS SOLUCIONES n° 1
( HACER TODO EN EL CARTAPACIO DE QUÍMICA)
A- Pepare una lista de 10 SOLUCIONES que sean Productos Comerciales de uso cotidiano (domésticos, personal, estético,
medicinales, etc). Si encuentra la Concentración (Cuantitativa) de estos productos anótelas.
B- Pepare una lista de 10 SOLUCIONES que sean preparadas en el Hogar cotidianamente.
C- Prediga basado en la diferencia de electronegatividades el Tipo de Enlace formado (Iónico, Covalente polar, o
Covalente no polar) y si una Molécula con este enlace es Soluble o No soluble en agua. Si es soluble en agua, entonces
prediga si su interacción es por Disociación de la molécula o por Puente de Hidrógeno.
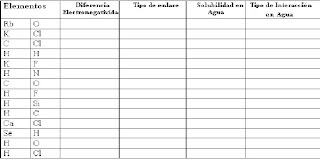
D- Observe estos compuestos y prediga ( teóricamente ) si son Solubles , parcialmente (Ligeramente ) solubles o
insolubles en agua. Sustente sus respuestas.
1- Petróleo
2- Tetracloruro de carbono (Investigue este Compuesto. OJO)
3- CH3NH2
4- Amoníaco gaseoso
5- CH3 (CH2)4 CH3
6- Óxido carbónico
7- C6H12O6 (Glucosa)
8- Cromato férrico
9- CH3 CH2-OH
10- Cloruro de hidrógeno gaseoso (Investigue este Compuesto.OJO)
11- Nitrato de amonio
12- Ácido clorhídrico(Investigue este Compuesto.OJO)
13- CH3-CH2 –OH
14- Eter de Petróleo
15- Hidróxido de magnesio
16- CH3-CH2 -Br
17- Sulfato de calcio
18- OH-CH2 -CH2 -OH
19- Carbonato de calcio
20- Mg (NO3 )2
21- CH3-CH2 -CH2 –F
22- CH3-CH2 –Cl
23- Cloruro de plata
24- Gasolina
25- C12 H22 O11 (Azúcar de Mesa)
26- CH3-CH2-CH2–I
27- Sulfuro de calcio
28- Ácido sulfúrico
E- Investigue y “ Sustente ” si las siguientes aseveraciones son Correctas o Falsas.
1- El Cloruro de sodio ( KCl ) es soluble en agua
2- El Cloruro de sodio (NaCl) es completamente soluble en Etanol ( C2H5 OH ) (Haga la Prueba o Investíguelo)
3- El Tetracloruro de carbono (CCl 4) es miscible en agua
4- El Tetracloruro de carbono es miscible en Benceno ( C6 H6 )
5- El gas Hidrógeno (H2) es soluble en agua
6- El gas Amoníaco es soluble en Hexano (C6 H14)
7- El Naftaleno sólido (Bolitas blancas para las polillas- C10 H8 ) es soluble en agua.
8- La Parafina ( material de las velas ) es soluble en Cloroformo (CHCl3)
F- A partir de las siguientes reacciones químicas ( realizadas en medio acuoso ); escriba en el espacio en blanco la fórmula
química del producto insoluble en agua.
1- Nitrato de plata + Cloruro de sodio R- ________________
2- Sulfato ( VI ) de diamonio + Hidróxido de plomo ( II ) R- ________________
3- Tris ( Dicromato ( VI ) ) de dialuminio + Óxido de potasio R- ________________
4- Sodio metálico libre + Ácido oxálico R- ________________
5- Cloruro de bario + Ácido fosfórico R- ________________
G- Reflexione y responda argumentando a las preguntas que se presentan a continuación.
1- ¿ Existe alguna diferencia al emplear los términos soluble y miscible ? Sí / No . Justifique su elección.
2- Explique por qué si el CO2 y el O 2 son gases No polares ; El CO2 es un poco más soluble en agua que el O 2 .
3- ¿ Qué líquido será mejor disolvente para el Naftaleno sólido (Bolitas blancas para las polillas- C10 H8 ); el agua o
el Tetracloruro de carbono (CCl4) ? Explique.
4- ¿ Qué líquido será mejor disolvente para el Sulfato de amonio; el agua o el Pentano (C5H12) ? Explique.
¿ En qué disolvente el Bromo líquido (Br2 ) líquido tendrá mayor solubilidad ; en agua o Benceno (C6H6)? Explique.
6- ¿ Qué sustancia es más polar el agua o el Etanol (C2H5OH) ?. Sustente su elección
Click aquí
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 °
TEMA: LAS SOLUCIONES n° 1
( HACER TODO EN EL CARTAPACIO DE QUÍMICA)
A- Pepare una lista de 10 SOLUCIONES que sean Productos Comerciales de uso cotidiano (domésticos, personal, estético,
medicinales, etc). Si encuentra la Concentración (Cuantitativa) de estos productos anótelas.
B- Pepare una lista de 10 SOLUCIONES que sean preparadas en el Hogar cotidianamente.
C- Prediga basado en la diferencia de electronegatividades el Tipo de Enlace formado (Iónico, Covalente polar, o
Covalente no polar) y si una Molécula con este enlace es Soluble o No soluble en agua. Si es soluble en agua, entonces
prediga si su interacción es por Disociación de la molécula o por Puente de Hidrógeno.

D- Observe estos compuestos y prediga ( teóricamente ) si son Solubles , parcialmente (Ligeramente ) solubles o
insolubles en agua. Sustente sus respuestas.
1- Petróleo
2- Tetracloruro de carbono (Investigue este Compuesto. OJO)
3- CH3NH2
4- Amoníaco gaseoso
5- CH3 (CH2)4 CH3
6- Óxido carbónico
7- C6H12O6 (Glucosa)
8- Cromato férrico
9- CH3 CH2-OH
10- Cloruro de hidrógeno gaseoso (Investigue este Compuesto.OJO)
11- Nitrato de amonio
12- Ácido clorhídrico(Investigue este Compuesto.OJO)
13- CH3-CH2 –OH
14- Eter de Petróleo
15- Hidróxido de magnesio
16- CH3-CH2 -Br
17- Sulfato de calcio
18- OH-CH2 -CH2 -OH
19- Carbonato de calcio
20- Mg (NO3 )2
21- CH3-CH2 -CH2 –F
22- CH3-CH2 –Cl
23- Cloruro de plata
24- Gasolina
25- C12 H22 O11 (Azúcar de Mesa)
26- CH3-CH2-CH2–I
27- Sulfuro de calcio
28- Ácido sulfúrico
E- Investigue y “ Sustente ” si las siguientes aseveraciones son Correctas o Falsas.
1- El Cloruro de sodio ( KCl ) es soluble en agua
2- El Cloruro de sodio (NaCl) es completamente soluble en Etanol ( C2H5 OH ) (Haga la Prueba o Investíguelo)
3- El Tetracloruro de carbono (CCl 4) es miscible en agua
4- El Tetracloruro de carbono es miscible en Benceno ( C6 H6 )
5- El gas Hidrógeno (H2) es soluble en agua
6- El gas Amoníaco es soluble en Hexano (C6 H14)
7- El Naftaleno sólido (Bolitas blancas para las polillas- C10 H8 ) es soluble en agua.
8- La Parafina ( material de las velas ) es soluble en Cloroformo (CHCl3)
F- A partir de las siguientes reacciones químicas ( realizadas en medio acuoso ); escriba en el espacio en blanco la fórmula
química del producto insoluble en agua.
1- Nitrato de plata + Cloruro de sodio R- ________________
2- Sulfato ( VI ) de diamonio + Hidróxido de plomo ( II ) R- ________________
3- Tris ( Dicromato ( VI ) ) de dialuminio + Óxido de potasio R- ________________
4- Sodio metálico libre + Ácido oxálico R- ________________
5- Cloruro de bario + Ácido fosfórico R- ________________
G- Reflexione y responda argumentando a las preguntas que se presentan a continuación.
1- ¿ Existe alguna diferencia al emplear los términos soluble y miscible ? Sí / No . Justifique su elección.
2- Explique por qué si el CO2 y el O 2 son gases No polares ; El CO2 es un poco más soluble en agua que el O 2 .
3- ¿ Qué líquido será mejor disolvente para el Naftaleno sólido (Bolitas blancas para las polillas- C10 H8 ); el agua o
el Tetracloruro de carbono (CCl4) ? Explique.
4- ¿ Qué líquido será mejor disolvente para el Sulfato de amonio; el agua o el Pentano (C5H12) ? Explique.
¿ En qué disolvente el Bromo líquido (Br2 ) líquido tendrá mayor solubilidad ; en agua o Benceno (C6H6)? Explique.
6- ¿ Qué sustancia es más polar el agua o el Etanol (C2H5OH) ?. Sustente su elección
jueves, 11 de marzo de 2010
Lab. Reacciones I Parte Qm. 2010
Para descargar el documento en limpio
Click Aquí
COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. LABORATORIO DE QUÍMICA 12 º
NIVEL: 12 °
Nº LISTA ( menor a mayor ): ____________________________________________________ Nº LISTA DE LOS AUSENTES: ______________________
Reacciones Químicas ( I Parte )
Materiales: Gradillas, tubos de ensayo, Papel toalla .
Reactivos: Solución de HCl (diluido) , Granallas ( piedras ) de Zn , Solución de CuSO4 , Clavitos o grapas de hierro , Solución de Pb( NO3 )2,, Solución de KI .
Introducción: Para esta primera parte de la experiencia procedemos a estudiar algunos tipos de reacciones. En general pueden considerarse los siguientes tipos de reacciones:
Simple Desplazamiento: Es la unión de un elemento con un compuesto, con liberación de uno de los elementos combinados en el mismo.
Ejemplo: 2 HCl + Fe -------------------------------------- FeCl2 + H2
Doble Desplazamiento o metátesis: Es la reacción entre dos compuestos con intercambio de elementos y formación de dos nuevos compuestos químicamente análogos a los reaccionantes.
Ejemplo: NaNO3 + KCl ------------------------------------ NaCl + KNO3
Procedimiento:
VOLUMEN EMPLEADO EN LOS TUBOS: 1/4 VOLUMEN O LA MITAD DE LA MITAD
A- Reacciones de Simple desplazamiento:
Vierta HCl (diluido) en un tubo de ensayo y agregue una granalla ( piedra) de Zn. Observe y anote todo lo que ocurre.
Coloque un poco de la Solución de CuSO4 (diluido) en un tubo de ensayo e introduzca una grapa de hierro bien pulida y déjelo reposar 10 minutos. Observe y anote lo que sucede.
- NOTA: EL HIERRO DE LA GRAPA AL REACCIONAR LO HACE EMPLEANDO EL MENOR NÚMERO DE OXIDACIÓN.
B- Reacciones de Doble desplazamiento:
Coloque en respectivos tubos de ensayo una solución (diluida) de KI ( 1/4 de volumen ) y en otro una solución (diluida) de Pb( NO3 )2.
Mezcle el contenido de ambos tubos. Observe y anote los resultados.
Taller de Laboratorio PARA RESOLVER QUÍMICA 12º
Reacciones de simple desplazamiento:
Mencione lo que observa al reaccionar HCl (diluido) con la granalla ( piedra) de cinc .
_________________________________________________________________
¿ El Zn que reaccionó con el HCl ( diluido ) (según el cambio del Nª de Oxidación en la reacción) se Oxida o se Reduce en esta reacción ?
_____________________________________________________________________
Explique su respuesta (basados en el cambio del Número de oxidación del Zn durante la reacción )
______________________________________________________________________
La reacción química estudiada calienta el tubo de ensayo durante este proceso ?: Sí / No ___________________________________________________
- ¿ Qué nombre reciben las reacciones que liberan calor durante el proceso ?: ____________________________________________________________
El gas que se desprendió en esta reacción es: ______________________________________________________________________
Explique por qué la granalla de cinc cambia de color durante su reacción con la solución de HCl.
_______________________________________________________________________
Justifique por qué se humedece la parte superior interior del tubo de ensayo durante la reacción ( ¿Qué se formó? ¿Cómo se formó?):
__________________________________________________________________________
________________________________________________________________________
Escriba la correcta ecuación química balanceada del proceso:_________________________________________________________________________
Mencione dos evidencias experimentales que lo llevan a concluir que hubo una reacción entre el HCl y el Zn.
a- __________________________________________________________________________
b- ________________________________________________________________________
Mencione lo que observa al añadir la grapa de hierro pulida en la Solución de CuSO4 por 10 minutos.
___________________________________________________________________
- ¿Cuál es el precipitado sólido que se deposita sobre la grapa de hierro a los 10 minutos ?: ________________________________________________
- ¿ Qué color presenta este precipitado ? ____________________________________________________________________
- ¿El hierro de la grapa del Número de oxidación del Fe durante la reacción )
__________________________________________________________________
Escriba la ecuación química de esta reacción correctamente balanceada ( utilice el Fe con el menor número de oxidación):
______________________________________________________________
Mencione dos evidencias experimentales que lo llevan a concluir que hubo reacción entre el Fe y CuSO4 .
a- ____________________________________________________________________
b- ____________________________________________________________________
Reacciones de doble desplazamiento:
- Mencione lo que observa al mezclar la Solución de KI con la Solución de Pb( NO3 )2 :
_______________________________________________________________________
- Fórmula química del producto de la reacción insoluble en agua ( precipitado): ___________________________________________________________
- Fórmula química del producto de la reacción soluble en agua ________________________________________________________________________
- Escriba la ecuación química balanceada para esta reacción: _________________________________________________________________________
Justifique la coloración amarilla de la solución resultante final ( Investigue el color de los productos obtenidos ).
___________________________________________________________________
Mencione dos evidencias experimentales que lo llevan a concluir que hubo reacción entre el KI y Pb(NO3)2
a- ____________________________________________________________________
b- _______________________________________________________________________
INVESTIGUE:
¿ Qué entendemos por Oxidación ?
______________________________________________________________________
Defina Reducción:
______________________________________________________________________
¿ Qué es una reacción de Óxido – Reducción ?:
______________________________________________________________________
Explique por qué todas las reacciones de Simple desplazamiento pueden ser consideradas como reacciones de Óxido – Reducción ( REDOX ).
_____________________________________________________________________
Explique por qué las reacciones de Combustión son consideradas reacciones REDOX ?:
______________________________________________________________________
Click Aquí
COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. LABORATORIO DE QUÍMICA 12 º
NIVEL: 12 °
Nº LISTA ( menor a mayor ): ____________________________________________________ Nº LISTA DE LOS AUSENTES: ______________________
Reacciones Químicas ( I Parte )
Materiales: Gradillas, tubos de ensayo, Papel toalla .
Reactivos: Solución de HCl (diluido) , Granallas ( piedras ) de Zn , Solución de CuSO4 , Clavitos o grapas de hierro , Solución de Pb( NO3 )2,, Solución de KI .
Introducción: Para esta primera parte de la experiencia procedemos a estudiar algunos tipos de reacciones. En general pueden considerarse los siguientes tipos de reacciones:
Simple Desplazamiento: Es la unión de un elemento con un compuesto, con liberación de uno de los elementos combinados en el mismo.
Ejemplo: 2 HCl + Fe -------------------------------------- FeCl2 + H2
Doble Desplazamiento o metátesis: Es la reacción entre dos compuestos con intercambio de elementos y formación de dos nuevos compuestos químicamente análogos a los reaccionantes.
Ejemplo: NaNO3 + KCl ------------------------------------ NaCl + KNO3
Procedimiento:
VOLUMEN EMPLEADO EN LOS TUBOS: 1/4 VOLUMEN O LA MITAD DE LA MITAD
A- Reacciones de Simple desplazamiento:
Vierta HCl (diluido) en un tubo de ensayo y agregue una granalla ( piedra) de Zn. Observe y anote todo lo que ocurre.
Coloque un poco de la Solución de CuSO4 (diluido) en un tubo de ensayo e introduzca una grapa de hierro bien pulida y déjelo reposar 10 minutos. Observe y anote lo que sucede.
- NOTA: EL HIERRO DE LA GRAPA AL REACCIONAR LO HACE EMPLEANDO EL MENOR NÚMERO DE OXIDACIÓN.
B- Reacciones de Doble desplazamiento:
Coloque en respectivos tubos de ensayo una solución (diluida) de KI ( 1/4 de volumen ) y en otro una solución (diluida) de Pb( NO3 )2.
Mezcle el contenido de ambos tubos. Observe y anote los resultados.
Taller de Laboratorio PARA RESOLVER QUÍMICA 12º
Reacciones de simple desplazamiento:
Mencione lo que observa al reaccionar HCl (diluido) con la granalla ( piedra) de cinc .
_________________________________________________________________
¿ El Zn que reaccionó con el HCl ( diluido ) (según el cambio del Nª de Oxidación en la reacción) se Oxida o se Reduce en esta reacción ?
_____________________________________________________________________
Explique su respuesta (basados en el cambio del Número de oxidación del Zn durante la reacción )
______________________________________________________________________
La reacción química estudiada calienta el tubo de ensayo durante este proceso ?: Sí / No ___________________________________________________
- ¿ Qué nombre reciben las reacciones que liberan calor durante el proceso ?: ____________________________________________________________
El gas que se desprendió en esta reacción es: ______________________________________________________________________
Explique por qué la granalla de cinc cambia de color durante su reacción con la solución de HCl.
_______________________________________________________________________
Justifique por qué se humedece la parte superior interior del tubo de ensayo durante la reacción ( ¿Qué se formó? ¿Cómo se formó?):
__________________________________________________________________________
________________________________________________________________________
Escriba la correcta ecuación química balanceada del proceso:_________________________________________________________________________
Mencione dos evidencias experimentales que lo llevan a concluir que hubo una reacción entre el HCl y el Zn.
a- __________________________________________________________________________
b- ________________________________________________________________________
Mencione lo que observa al añadir la grapa de hierro pulida en la Solución de CuSO4 por 10 minutos.
___________________________________________________________________
- ¿Cuál es el precipitado sólido que se deposita sobre la grapa de hierro a los 10 minutos ?: ________________________________________________
- ¿ Qué color presenta este precipitado ? ____________________________________________________________________
- ¿El hierro de la grapa del Número de oxidación del Fe durante la reacción )
__________________________________________________________________
Escriba la ecuación química de esta reacción correctamente balanceada ( utilice el Fe con el menor número de oxidación):
______________________________________________________________
Mencione dos evidencias experimentales que lo llevan a concluir que hubo reacción entre el Fe y CuSO4 .
a- ____________________________________________________________________
b- ____________________________________________________________________
Reacciones de doble desplazamiento:
- Mencione lo que observa al mezclar la Solución de KI con la Solución de Pb( NO3 )2 :
_______________________________________________________________________
- Fórmula química del producto de la reacción insoluble en agua ( precipitado): ___________________________________________________________
- Fórmula química del producto de la reacción soluble en agua ________________________________________________________________________
- Escriba la ecuación química balanceada para esta reacción: _________________________________________________________________________
Justifique la coloración amarilla de la solución resultante final ( Investigue el color de los productos obtenidos ).
___________________________________________________________________
Mencione dos evidencias experimentales que lo llevan a concluir que hubo reacción entre el KI y Pb(NO3)2
a- ____________________________________________________________________
b- _______________________________________________________________________
INVESTIGUE:
¿ Qué entendemos por Oxidación ?
______________________________________________________________________
Defina Reducción:
______________________________________________________________________
¿ Qué es una reacción de Óxido – Reducción ?:
______________________________________________________________________
Explique por qué todas las reacciones de Simple desplazamiento pueden ser consideradas como reacciones de Óxido – Reducción ( REDOX ).
_____________________________________________________________________
Explique por qué las reacciones de Combustión son consideradas reacciones REDOX ?:
______________________________________________________________________
martes, 9 de marzo de 2010
DISOLUCIONES
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 °
Apuntes de Química 12° Tema: Las disoluciones
Mezcla: Combinación de dos o más sustancias puras.
Fase: Cada una de las partes homogéneas ( iguales ) de un sistema heterogéneo. Región de materia cuyo conjunto de propiedades son idénticas. Cada una de las partes distinguibles en una mezcla.
Mezcla Homogénea: Combinación de dos o más sustancias en donde se observa o distingue una sola fase y la composición es uniforme (Sal-Agua).
Mezcla Heterogénea: Combinación de dos o más sustancias en donde físicamente se observan más de una fase y cuya composición no es uniforme (Arena- Agua).
Disolución: Mezcla homogénea de dos o más sustancias . Está constituida por dos componentes básicos: Soluto y Solvente.
Soluto: Sustancia que se disuelve y que se encuentra presente en la solución en menor cantidad ( en gramos ).
Solvente: Sustancia que disuelve y que se encuentra presente en la solución en mayor cantidad ( en gramos ).
TIPOS DE DISOLUCIONES

Electronegatividad: Atracción que ejerce un átomo sobre los electrones que forman un enlace químico. Aumenta en los períodos de la Tabla Periódica hacia la derecha y en los grupos o familias hacia arriba. Es mayor entre más pequeños sea el átomo.
Disolver: Dispersar las moléculas o iones del soluto entre las moléculas del disolvente de manera tal que ocurra una interacción o atracción entre las moléculas del solvente y del soluto. En estas interacciones actúan las polaridades o cargas positivas – negativas de los polos de las moléculas participantes. Ésta polaridad depende de la electronegatividad de los elementos.
Tabla de Electronegatividad

Enlace iónico: Ocurre por transferencia de electrones de un átomo a otro más electronegativo. La diferencia de electronegatividad de los átomos es ≥ 1.7. Ejemplos: Na –Cl (2.1); Mg – F (2.8); Li – Br (1.8).
Estos enlaces son polares ya que existen polos positivos – negativos definidos.
Enlace Covalente: Ocurre por compartimiento de electrones entre dos átomos de parecida o igual electronegatividad. La diferencia de electronegatividad de los átomos es < 1.7. Se dividen en enlaces: Covalente polar y Covalente no polar.
Covalente Polar: Ocurre por compartimiento de electrones entre dos átomos de parecida electronegatividad. La diferencia de electronegatividad de los átomos es 0.8 – 1.6.
Estos enlaces son polares ya que existen polos positivos – negativos.
Ejemplos: H – O ( 1.4 ) H – Cl ( 0.9 ) Excepción: H – F (1.9 ) pareciera iónico pero es covalente polar, ya que el H forma siempre enlaces de tipo covalente.
Covalente No Polar: Se da por compartimiento de electrones entre dos átomos de igual o parecida electronegatividad. La diferencia de electronegatividad de los átomos es de 0.0 – 0.7 . En estos enlaces ambos átomos tienen la misma capacidad para atraer los electrones del enlace; por esta razón no se forman polos con cargas definidas sino polos transitorios.
Ejemplos: Cl – Cl ( 0 ) ; C – H ( 0.4 ) ; Br – C ( 0.3 ).
Solubilidad: Propiedad física que indica la capacidad de una sustancia de dispersarse o disolverse completa o parcialmente en otra por medio de atracciones electrostáticas.
Disolución de Sustancias iónicas:
Los iones de los compuestos iónicos ( NaCl ) al ser disueltos en H2O (covalente polar) se disocian y se separan de la red cristalina de la sal dispersándose en el solvente ; e individualmente son rodeados por las moléculas polares del agua. Éstas moléculas de agua orientan sus polos negativos ( átomos de oxígeno ) para rodear los iones positivos de la sal ( Na 1 + ), mientras que los iones negativos (Cl 1–) son rodeados por los polos o extremos positivos ( átomos de hidrógeno).
Disolución de Sustancias Covalentes Polares
Estas disoluciones se hacen mediante interacciones conocidas como “ Puentes de Hidrógeno ”.
Puentes de Hidrógeno: Interacción covalente entre el H y átomos electronegativos preferiblemente como O, N, F. Este tipo de interacción se experimenta entre las propias moléculas de agua en sus enlaces H -O.
Las sustancias covalentes polares tienen grupos moleculares similares en carga a los del agua por lo que son muy compatibles con éstas. Moléculas como la Glucosa (C6H12O6) ; Sacarosa (C12H22O11) (Azúcar de mesa); Etanol ( C2H6O ) ( Alcohol etílico ), son ejemplos de moléculas polares que forman interacciones “Puentes de Hidrógeno” con las moléculas de agua .
Las moléculas covalentes polares NO SE DISOCIAN en agua; por el contrario permanece intacta y lo que ocurre es una interacción de los polos de estas moléculas con los polos positivos o negativos del agua mediante atracciones puente de Hidrógeno.
Hay sustancias que NO son solubles en agua ya que están formados únicamente por enlaces covalentes no polares ( C – H ). Ejemplo de estas sustancias son los hidrocarburos o derivados del petróleo ( largas cadenas de C –H ) y los aceites que también son moléculas formadas por largas cadenas de C –H.
Reglas de solubilidad de las sustancias: Basados en los criterios estudiados podemos concluir con las reglas “Lo igual disuelve lo igual”. Esto se refiere a que sustancias polares de disuelven en sustancias polares y sustancias no polares se disuelven en sustancias no polares.
A continuación los siguientes criterios para estudiar la solubilidad de compuestos iónicos en agua a 25°C.
Nota: Estas reglas de solubilidad se basan en observaciones experimentales ya que NO hay regla sencilla que nos permita predecir o explicar con certeza la solubilidad de los diferentes compuestos iónicos.

Cuando empleamos solutos sólidos (Sal de cocina), su disolución en agua se expresa usando la expresión soluble o no soluble; si se trata de solutos líquidos (Alcohol ), su disolución en agua se expresa usando la expresión: Líquidos miscibles o inmiscibles.
Los líquidos son miscibles cuando los líquidos se combinan completamente en cualquier proporción para formar una solución.
Los líquidos son inmiscibles: Cuando los líquidos no se mezclan sino que forman capas separadas. Ninguno de los dos se disuelven de manera apreciable en el otro.
FACTORES QUE AFECTAN LA SOLUBILIDAD DE LAS SUSTANCIAS.
La solubilidad depende de:
1- Naturaleza Química Soluto-Solvente: Sustancias polares se disuelven en solventes polares y sustancias no polares se disuelven en solventes no polares o apolares. Regla: “Lo igual disuelve lo igual”.
2- Temperatura: La solubilidad de la mayoría de los sólidos en un líquido por lo general aumenta con la temperatura la cual facilita la cinética química y las interacciones entre soluto-solvente. A grosso modo se puede deducir la siguiente regla: “ La solubilidad de solutos sólidos generalmente es directamente proporcional a la temperatura ”.
En los sistemas Gas-Líquidos; “La solubilidad de solutos gaseosos es inversamente proporcional a la temperatura ”, es por esto que observamos el burbujeo al hervir el agua debido a los gases disueltos en esta: H2 , O2 , N2, CO2.
Aquí juega un papel relevante la densidad del gas ( masa / volumen ) que es afectada por la temperatura, siguiendo la Ley de los gases de Charles ( Volumen del gas a Temperatura ). A mayor temperatura > Volumen y por ende menor Densidad por lo que el gas es más liviano y se separa del líquido. Lo contrario ocurre si disminuye la temperatura , por lo que el gas se hace más pesado ( aumenta su densidad ) y se queda en el líquido.
3- Presión: Ésta NO afecta los sistemas Sólidos-Líquidos; sólo perturba los sistemas Gas-Líquidos. “ La solubilidad de un soluto gaseoso es directamente proporcional a la presión ”. Es por ésto que al destapar una soda la disminución de la presión en el sistema permite el escape del exceso de CO2 y se observa efervescencia.
Aquí juega también un papel importante la densidad del gas ( masa / volumen ) que es afectada por la presión, siguiendo la Ley de los gases de Boyle ( Volumen del gas 1 / a Presión ). A mayor presión < Volumen y por ende mayor Densidad por lo que el gas es más pesado y se queda en el líquido. Lo contrario ocurre si disminuye la presión , por lo que el gas se hace más liviano
( disminuye su densidad ) y se separa del líquido.
FACTORES QUE AFECTAN LA VELOCIDAD DE DISOLUCIÓN DE LAS SUSTANCIAS.
La velocidad de disolución depende de:
1- Tamaño de las partículas: Las partículas más finas o trituradas tienen mayor área de superficie expuestas al disolvente y esto facilita las interacciones entre el soluto-solvente. Se hace entonces más fácil la dispersión del soluto en el solvente.
2- Velocidad de agitación ( Agitación mecánica ): Se aumentan así las interacciones soluto-solvente debido a que el soluto no disuelto se aproxima para unirse más rápido al solvente. La agitación por ende mejora la dispersión del soluto en el solvente.
3- Temperatura: Este factor también afecta las interacciones entre las moléculas del soluto con el solvente ya que aumenta el grado de movimiento entre las moléculas del sistema. Se facilita así la dispersión del soluto en el solvente.
Concentración: Relación entre la cantidad de soluto y cantidad de solvente en una solución. Medida de la cantidad del soluto contenido en una cantidad de disolvente o solución.
La concentración de una solución se puede expresar cualitativamente y cuantitativamente.
Medición Cualitativa de la concentración de soluciones: Se basa en la apreciación que hacemos nosotros de una concentración (cantidad de soluto en un solvente) basándonos en nuestros sentidos (gusto, olfato). Esta apreciación es subjetiva y relativa; no igual para todos.
Para sistemas líquidos-líquidos, las medidas cualitativas más comunes son: Concentradas (alta cantidad de soluto) y Diluidas (baja cantidad de soluto).
Para sistemas Sólidos- líquidos, las medidas cualitativas de concentración más comunes son: Solución no saturada, Saturada, Sobresaturada.
Para referirnos a estas medidas cualitativas de expresar concentraciones es necesario considerar que sin importar lo finas o pequeñas que sean las partículas de soluto, lo caliente que esté el solvente, o lo mucho o rápido que agitemos el sistema soluto-solvente; en algún momento el solvente ya no podrá contener en sus enlaces o puntos de interacción ninguna molécula de soluto, por lo que el exceso de soluto se precipita o cristaliza y se va al fondo del recipiente porque se ha excedido la concentración máxima de soluto que puede retener el solvente. Las medida de la cantidad máxima de un soluto a determinadas temperaturas ya están estandarizadas para cada sustancia y se conocen como LÍMITES DE SOLUBILIDAD.
Equilibrio Dinámico: Estado en el que la velocidad de disolución de un soluto no disuelto es igual a la velocidad de cristalización del soluto disuelto, por lo que la cantidad neta de soluto no disuelto y disuelto en solución permanece constante. Este equilibrio se puede representar de la siguiente forma:
Soluto No disuelto Velocidad de disolución Soluto Disuelto
Velocidad de cristalización
Esta dinámica del sistema no es apreciable a nivel macro sino a nivel molecular (microscópico).
Solución No Saturada: Aquellas donde la cantidad de soluto que contiene la solución es menor que la que se puede disolver o que puede aceptar el disolvente como máximo. En ellas la Velocidad de disolución > Velocidad de cristalización del soluto.
Solución Saturada: Es aquella que contiene la cantidad máxima de soluto que puede hallarse disuelta en el disolvente.
En estas soluciones la Velocidad de disolución = Velocidad de cristalización del soluto.
Estas soluciones se encuentran en equilibrio dinámico con el soluto disuelto y el no disuelto, por lo tanto las concentraciones de éstos solutos (disuelto y no disuelto) permanecen constantes.
Solución Sobresaturada: Solución en la cual la cantidad del soluto es mayor de la que puede aceptar el disolvente como máximo. Se prepara calentando la solución a altas temperaturas para obligar a las moléculas del solvente a interactuar con el soluto y aceptarlo en disolución. Son soluciones inestables ya que al bajar la temperatura se debilitan las falsas interacciones
soluto- solvente y el soluto cristaliza o precipita. En estas soluciones la Velocidad de cristalización del soluto disuelto > Velocidad de disolución del soluto no disuelto.
PARA DESCARGAR EL DOCUMENTO
Click Aquí
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 °
Apuntes de Química 12° Tema: Las disoluciones
Mezcla: Combinación de dos o más sustancias puras.
Fase: Cada una de las partes homogéneas ( iguales ) de un sistema heterogéneo. Región de materia cuyo conjunto de propiedades son idénticas. Cada una de las partes distinguibles en una mezcla.
Mezcla Homogénea: Combinación de dos o más sustancias en donde se observa o distingue una sola fase y la composición es uniforme (Sal-Agua).
Mezcla Heterogénea: Combinación de dos o más sustancias en donde físicamente se observan más de una fase y cuya composición no es uniforme (Arena- Agua).
Disolución: Mezcla homogénea de dos o más sustancias . Está constituida por dos componentes básicos: Soluto y Solvente.
Soluto: Sustancia que se disuelve y que se encuentra presente en la solución en menor cantidad ( en gramos ).
Solvente: Sustancia que disuelve y que se encuentra presente en la solución en mayor cantidad ( en gramos ).
TIPOS DE DISOLUCIONES

Electronegatividad: Atracción que ejerce un átomo sobre los electrones que forman un enlace químico. Aumenta en los períodos de la Tabla Periódica hacia la derecha y en los grupos o familias hacia arriba. Es mayor entre más pequeños sea el átomo.
Disolver: Dispersar las moléculas o iones del soluto entre las moléculas del disolvente de manera tal que ocurra una interacción o atracción entre las moléculas del solvente y del soluto. En estas interacciones actúan las polaridades o cargas positivas – negativas de los polos de las moléculas participantes. Ésta polaridad depende de la electronegatividad de los elementos.
Tabla de Electronegatividad

Enlace iónico: Ocurre por transferencia de electrones de un átomo a otro más electronegativo. La diferencia de electronegatividad de los átomos es ≥ 1.7. Ejemplos: Na –Cl (2.1); Mg – F (2.8); Li – Br (1.8).
Estos enlaces son polares ya que existen polos positivos – negativos definidos.
Enlace Covalente: Ocurre por compartimiento de electrones entre dos átomos de parecida o igual electronegatividad. La diferencia de electronegatividad de los átomos es < 1.7. Se dividen en enlaces: Covalente polar y Covalente no polar.
Covalente Polar: Ocurre por compartimiento de electrones entre dos átomos de parecida electronegatividad. La diferencia de electronegatividad de los átomos es 0.8 – 1.6.
Estos enlaces son polares ya que existen polos positivos – negativos.
Ejemplos: H – O ( 1.4 ) H – Cl ( 0.9 ) Excepción: H – F (1.9 ) pareciera iónico pero es covalente polar, ya que el H forma siempre enlaces de tipo covalente.
Covalente No Polar: Se da por compartimiento de electrones entre dos átomos de igual o parecida electronegatividad. La diferencia de electronegatividad de los átomos es de 0.0 – 0.7 . En estos enlaces ambos átomos tienen la misma capacidad para atraer los electrones del enlace; por esta razón no se forman polos con cargas definidas sino polos transitorios.
Ejemplos: Cl – Cl ( 0 ) ; C – H ( 0.4 ) ; Br – C ( 0.3 ).
Solubilidad: Propiedad física que indica la capacidad de una sustancia de dispersarse o disolverse completa o parcialmente en otra por medio de atracciones electrostáticas.
Disolución de Sustancias iónicas:
Los iones de los compuestos iónicos ( NaCl ) al ser disueltos en H2O (covalente polar) se disocian y se separan de la red cristalina de la sal dispersándose en el solvente ; e individualmente son rodeados por las moléculas polares del agua. Éstas moléculas de agua orientan sus polos negativos ( átomos de oxígeno ) para rodear los iones positivos de la sal ( Na 1 + ), mientras que los iones negativos (Cl 1–) son rodeados por los polos o extremos positivos ( átomos de hidrógeno).
Disolución de Sustancias Covalentes Polares
Estas disoluciones se hacen mediante interacciones conocidas como “ Puentes de Hidrógeno ”.
Puentes de Hidrógeno: Interacción covalente entre el H y átomos electronegativos preferiblemente como O, N, F. Este tipo de interacción se experimenta entre las propias moléculas de agua en sus enlaces H -O.
Las sustancias covalentes polares tienen grupos moleculares similares en carga a los del agua por lo que son muy compatibles con éstas. Moléculas como la Glucosa (C6H12O6) ; Sacarosa (C12H22O11) (Azúcar de mesa); Etanol ( C2H6O ) ( Alcohol etílico ), son ejemplos de moléculas polares que forman interacciones “Puentes de Hidrógeno” con las moléculas de agua .
Las moléculas covalentes polares NO SE DISOCIAN en agua; por el contrario permanece intacta y lo que ocurre es una interacción de los polos de estas moléculas con los polos positivos o negativos del agua mediante atracciones puente de Hidrógeno.
Hay sustancias que NO son solubles en agua ya que están formados únicamente por enlaces covalentes no polares ( C – H ). Ejemplo de estas sustancias son los hidrocarburos o derivados del petróleo ( largas cadenas de C –H ) y los aceites que también son moléculas formadas por largas cadenas de C –H.
Reglas de solubilidad de las sustancias: Basados en los criterios estudiados podemos concluir con las reglas “Lo igual disuelve lo igual”. Esto se refiere a que sustancias polares de disuelven en sustancias polares y sustancias no polares se disuelven en sustancias no polares.
A continuación los siguientes criterios para estudiar la solubilidad de compuestos iónicos en agua a 25°C.
Nota: Estas reglas de solubilidad se basan en observaciones experimentales ya que NO hay regla sencilla que nos permita predecir o explicar con certeza la solubilidad de los diferentes compuestos iónicos.

Cuando empleamos solutos sólidos (Sal de cocina), su disolución en agua se expresa usando la expresión soluble o no soluble; si se trata de solutos líquidos (Alcohol ), su disolución en agua se expresa usando la expresión: Líquidos miscibles o inmiscibles.
Los líquidos son miscibles cuando los líquidos se combinan completamente en cualquier proporción para formar una solución.
Los líquidos son inmiscibles: Cuando los líquidos no se mezclan sino que forman capas separadas. Ninguno de los dos se disuelven de manera apreciable en el otro.
FACTORES QUE AFECTAN LA SOLUBILIDAD DE LAS SUSTANCIAS.
La solubilidad depende de:
1- Naturaleza Química Soluto-Solvente: Sustancias polares se disuelven en solventes polares y sustancias no polares se disuelven en solventes no polares o apolares. Regla: “Lo igual disuelve lo igual”.
2- Temperatura: La solubilidad de la mayoría de los sólidos en un líquido por lo general aumenta con la temperatura la cual facilita la cinética química y las interacciones entre soluto-solvente. A grosso modo se puede deducir la siguiente regla: “ La solubilidad de solutos sólidos generalmente es directamente proporcional a la temperatura ”.
En los sistemas Gas-Líquidos; “La solubilidad de solutos gaseosos es inversamente proporcional a la temperatura ”, es por esto que observamos el burbujeo al hervir el agua debido a los gases disueltos en esta: H2 , O2 , N2, CO2.
Aquí juega un papel relevante la densidad del gas ( masa / volumen ) que es afectada por la temperatura, siguiendo la Ley de los gases de Charles ( Volumen del gas a Temperatura ). A mayor temperatura > Volumen y por ende menor Densidad por lo que el gas es más liviano y se separa del líquido. Lo contrario ocurre si disminuye la temperatura , por lo que el gas se hace más pesado ( aumenta su densidad ) y se queda en el líquido.
3- Presión: Ésta NO afecta los sistemas Sólidos-Líquidos; sólo perturba los sistemas Gas-Líquidos. “ La solubilidad de un soluto gaseoso es directamente proporcional a la presión ”. Es por ésto que al destapar una soda la disminución de la presión en el sistema permite el escape del exceso de CO2 y se observa efervescencia.
Aquí juega también un papel importante la densidad del gas ( masa / volumen ) que es afectada por la presión, siguiendo la Ley de los gases de Boyle ( Volumen del gas 1 / a Presión ). A mayor presión < Volumen y por ende mayor Densidad por lo que el gas es más pesado y se queda en el líquido. Lo contrario ocurre si disminuye la presión , por lo que el gas se hace más liviano
( disminuye su densidad ) y se separa del líquido.
FACTORES QUE AFECTAN LA VELOCIDAD DE DISOLUCIÓN DE LAS SUSTANCIAS.
La velocidad de disolución depende de:
1- Tamaño de las partículas: Las partículas más finas o trituradas tienen mayor área de superficie expuestas al disolvente y esto facilita las interacciones entre el soluto-solvente. Se hace entonces más fácil la dispersión del soluto en el solvente.
2- Velocidad de agitación ( Agitación mecánica ): Se aumentan así las interacciones soluto-solvente debido a que el soluto no disuelto se aproxima para unirse más rápido al solvente. La agitación por ende mejora la dispersión del soluto en el solvente.
3- Temperatura: Este factor también afecta las interacciones entre las moléculas del soluto con el solvente ya que aumenta el grado de movimiento entre las moléculas del sistema. Se facilita así la dispersión del soluto en el solvente.
Concentración: Relación entre la cantidad de soluto y cantidad de solvente en una solución. Medida de la cantidad del soluto contenido en una cantidad de disolvente o solución.
La concentración de una solución se puede expresar cualitativamente y cuantitativamente.
Medición Cualitativa de la concentración de soluciones: Se basa en la apreciación que hacemos nosotros de una concentración (cantidad de soluto en un solvente) basándonos en nuestros sentidos (gusto, olfato). Esta apreciación es subjetiva y relativa; no igual para todos.
Para sistemas líquidos-líquidos, las medidas cualitativas más comunes son: Concentradas (alta cantidad de soluto) y Diluidas (baja cantidad de soluto).
Para sistemas Sólidos- líquidos, las medidas cualitativas de concentración más comunes son: Solución no saturada, Saturada, Sobresaturada.
Para referirnos a estas medidas cualitativas de expresar concentraciones es necesario considerar que sin importar lo finas o pequeñas que sean las partículas de soluto, lo caliente que esté el solvente, o lo mucho o rápido que agitemos el sistema soluto-solvente; en algún momento el solvente ya no podrá contener en sus enlaces o puntos de interacción ninguna molécula de soluto, por lo que el exceso de soluto se precipita o cristaliza y se va al fondo del recipiente porque se ha excedido la concentración máxima de soluto que puede retener el solvente. Las medida de la cantidad máxima de un soluto a determinadas temperaturas ya están estandarizadas para cada sustancia y se conocen como LÍMITES DE SOLUBILIDAD.
Equilibrio Dinámico: Estado en el que la velocidad de disolución de un soluto no disuelto es igual a la velocidad de cristalización del soluto disuelto, por lo que la cantidad neta de soluto no disuelto y disuelto en solución permanece constante. Este equilibrio se puede representar de la siguiente forma:
Soluto No disuelto Velocidad de disolución Soluto Disuelto
Velocidad de cristalización
Esta dinámica del sistema no es apreciable a nivel macro sino a nivel molecular (microscópico).
Solución No Saturada: Aquellas donde la cantidad de soluto que contiene la solución es menor que la que se puede disolver o que puede aceptar el disolvente como máximo. En ellas la Velocidad de disolución > Velocidad de cristalización del soluto.
Solución Saturada: Es aquella que contiene la cantidad máxima de soluto que puede hallarse disuelta en el disolvente.
En estas soluciones la Velocidad de disolución = Velocidad de cristalización del soluto.
Estas soluciones se encuentran en equilibrio dinámico con el soluto disuelto y el no disuelto, por lo tanto las concentraciones de éstos solutos (disuelto y no disuelto) permanecen constantes.
Solución Sobresaturada: Solución en la cual la cantidad del soluto es mayor de la que puede aceptar el disolvente como máximo. Se prepara calentando la solución a altas temperaturas para obligar a las moléculas del solvente a interactuar con el soluto y aceptarlo en disolución. Son soluciones inestables ya que al bajar la temperatura se debilitan las falsas interacciones
soluto- solvente y el soluto cristaliza o precipita. En estas soluciones la Velocidad de cristalización del soluto disuelto > Velocidad de disolución del soluto no disuelto.
PARA DESCARGAR EL DOCUMENTO
Click Aquí
miércoles, 3 de marzo de 2010
Problemas del Ejercicio del Viernes 5 de marzo
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA NIVEL: 12 °
TEMa: REPASO mol, Estequiometría Química Y REACTIVO LIMITANTE
NOTA : A C. N ( Condiciones Normales de temperatura y Presión TPN ) Se usa 1 Mol = 22.4 dm3
A- MOL:
1- Un hueso prehistórico pesa 1.50 Kg; se sabe que el hueso contiene 60 % de Fosfato de calcio. ¿ Cuál es la masa
en gramos de calcio que hay en el hueso? R: 266.7 g
2- ¿ Cuál es el número total de átomos que hay en una cámara que contiene 1.50 X 1021 moléculas de Hidrógeno
gaseoso, 23 g de Dióxido de nitrógeno, y 0.20 moles de Argón. R: 1.026 X 1024 átomos
3- Calcule los átomos de Cobre que están presentes en 30 g de Sulfato cúprico. R: 1.13 X 1023 átomos
4- Determine los gramos de Oxígeno presentes en 196 g de Ácido sulfúrico. R: 128 g
5- ¿ Cuál es la masa en gramos presente en 1 átomo de Azufre ? R: 5.33 X 10 – 23 gramos.
B- Estequiometría Química
1- Dada la ecuación:
Óxido manganoso (s) + Ácido clorhídrico (ac) ------------- Cloruro hipomanganoso (ac) + Cloro libre + Agua ( L )
a- Calcule los dm3 de Cloro libre a C.N. preparados a partir de 20.0 g del reactivo-agente reductor de la reacción.
b- Si en esta reacción se obtuvieron solamente 2.67 X 10 3 cm3 de Cloro (g); calcule el % de rendimiento de la
reacción. R: a - 3.11 dm3 b - 85.85 %
2- El Amoníaco (g) reacciona con Oxígeno (g) para producir Óxido de nitrógeno (II) (g) y Agua (g).
A partir de 85.15 g del hidruro : a- ¿ Cuántos gramos de Agua se producen ? b- Determine las moles de Oxígeno
consumidas. c- Calcule las moléculas del óxido no metálico producido. d- Si realmente se obtienen 152.06 g del
óxido no metálico al 97 % de pureza; ¿ cuál es el % de rendimiento de la reacción ?.
R : a- 135.15 g b- 6. 25 moles c- 3. 01 x10 24 moléculas d- 98.38 %
3- Se descomponen por el calor 16.25 g de Clorato de potasio (s) con una pureza del 80 % de pureza; a- Calcular la
masa en gramos del gas producido. b- Si el gas producido ocupa un volumen de 3.94 L bajo condiciones de
300 ° K ; Determine la presión del gas en unidad Torr. R : a- 5.11 g b- 760 Torr
(Nota: Calcule primero la masa pura de la sustancia en base al % dado )
4- ¿Cuántas moles de hidróxido de sodio se requieren para neutralizar completamente 100 g de Ácido sulfúrico ?
R: 2.04 moles
5- ¿Cuántas moléculas de Metano (g) se producirán cuando se preparan 0.200 g de Hidróxido de aluminio a partir de la
reacción de Carburo de aluminio (s) con agua ( L) ? R : 1.16 x 10 21 moléculas
6- Determine los gramos de Oxígeno (g) que se obtienen por la descomposición de 100 g de Peróxido de calcio (s).
b- Si se obtienen realmente 23.62 g del no metal (g) al 88.70 % de pureza; determine el % de rendimiento del
producto generado. R: a- 22.22 g b- 94.29 %
7- Evaluar los dm3 de Oxígeno (g) en C.N. que se utilizan en la combustión completa (Reacción con Oxígeno) de 150 g
de Propano (g) (C3H8) al 97 % de pureza en masa . R: 370.36 dm3
C- REACTIVO LIMITANTE
1- Si 50.0 g de Carbonato de calcio (s) reaccionan con 35.0 g de Ácido fosfórico (ac) (Comparar con Producto: gramos
de la Oxosal), calcule; a) El reactivo limitante b) Los gramos de la oxosal que se producen c) La masa del reactivo
en exceso que queda al final de la reacción d) El % de rendimiento de la reacción si realmente se obtienen 53.89 g
de la oxosal al 90 % de pureza en masa. e) Las moléculas de agua que se producen f) Los átomos totales de
Oxígeno en el agua producida en la reacción. R. a - Carbonato de calcio b - 51.67g c - 2.352 g
d - 94 % e- XXXXXX f- XXXXXXX
2- Bajo C.N 79.8 litros de Hidrógeno (g) reaccionan en un recipiente con 24.5 litros de Nitrógeno (g) (Comparar con
Producto: Moléculas del Hidruro no metálico), calcular: a) El reactivo limitante b) Las moléculas del hidruro no
metálico (g) formado c) Determine las moles del reactivo en exceso que se obtienen al final de la reacción.
d) Si realmente se obtienen 1.123 X 10 24 moléculas del hidruro al 96 % de pureza en masa ; ¿cuál es el % de
rendimiento de la reacción ?. R. a - Nitrógeno b - 1.32 X 10 24 c - 0.28mol d - 82 %
3- Se dejó que una muestra de 16.5 g de Óxido cromoso (s) reaccione con 8.20 g de Aluminio (s). (Comparar con
Producto: gramos del metal ); Calcule: a) El reactivo limitante b) Los gramos de Cromo (s) que se pueden
producir c) Las moles de reactivo en exceso que quedan al terminar la reacción d) El % rendimiento de la
reacción si se obtienen realmente 10.9 g de Cromo. R. a - Óxido cromoso b = 11.3 g c - 0.086 mol
d - 96.5 %
PROBLEMAS CARIÑOSOS
A- Estequiometría Química
1- Una muestra de Hierro (s) reacciona con suficiente Ácido clorhídrico (ac). Determine ; a- ¿ Cuál es la masa del gas
obtenido en la reacción a partir de 11.17 g del reactivo - agente reductor ? b- Calcule el % de rendimiento de la
reacción si realmente se obtienen 0.382 g del gas al 91.70 % de pureza ? R: a- 0.40g b- 87.5 %
(Nota: Oxidación –Pierde Electrones- Aumento del NUMOX- Agente Reductor.
Reducción –Gana electrones- Disminuye el NUMOX- Agente Oxidante )
2- Se determinó en un análisis; que por el proceso de combustión al quemar 0.1005 g de Mentol (compuesto a base
de C, H, O ) , se produce : 0.2829 g de Dióxido de carbono y 0.1159 g de Agua. Si la masa molar del Mentol es de
156 g/mol ; determine : a- La Fórmula Empírica b- La Fórmula verdadera R: a- (C10H20O)n b- C10H20O
(Nota: Calcular primero las masas de Carbono, Hidrógeno y Oxígeno en el compuesto Original; posteriormente
determinar las moles de cada elemento.)
3- Se hace reaccionar Al (s) con Ácido clorhídrico (ac). El Hidrógeno obtenido a partir de esta reacción se hace pasar
por una muestra de Óxido cúprico (s), logrando así la separación del Cobre metálico sólido. ¿Cuántos gramos de
cobre metálico se obtendrán cuando 16. 64 g de Aluminio (s) se hacen reaccionar con el hidrácido?. R : 58.80 g
(Nota: Hacer ecuaciones de reacciones parciales por cada etapa. Luego Sumar ambas etapas y obtener una sola
ecuación)
B- REACTIVO LIMITANTE
1- Durante la I Guerra Mundial se empleó la sustancia Fosfina (g), como gas venenoso contra las tropas enemigas
aliadas en las trincheras. Este gas junto con el Hidróxido de sodio como producto secundario, se obtienen por la
reacción que se da al disolver el Fosfuro de sodio (s) en Agua (L). Si disolvemos 150 g de la sal en 250 ml de
Agua (L) (Comparar con Producto: gramos del Hidruro no metálico ); determine para esta reacción: a) El reactivo
limitante b) Los gramos de agua que reaccionan con toda la sal presente c) El rendimiento teórico (cantidad) de
Fosfina en gramos d) Si se obtienen 46 g de Fosfina en esta reacción , ¿ cuál es el % de rendimiento de la
reacción ? e) Las moléculas de la base o Hidróxido producida. f) Los átomos TOTALES de los elementos que
forman la base producida.
R: a- Fosfuro de sodio b- 81g c- 51g d- 90.20 % e- XXXXX f- XXXXXX
Para descargar el documento
Dale click aqui
PROFESOR: SADAY E. ZAPATA NIVEL: 12 °
TEMa: REPASO mol, Estequiometría Química Y REACTIVO LIMITANTE
NOTA : A C. N ( Condiciones Normales de temperatura y Presión TPN ) Se usa 1 Mol = 22.4 dm3
A- MOL:
1- Un hueso prehistórico pesa 1.50 Kg; se sabe que el hueso contiene 60 % de Fosfato de calcio. ¿ Cuál es la masa
en gramos de calcio que hay en el hueso? R: 266.7 g
2- ¿ Cuál es el número total de átomos que hay en una cámara que contiene 1.50 X 1021 moléculas de Hidrógeno
gaseoso, 23 g de Dióxido de nitrógeno, y 0.20 moles de Argón. R: 1.026 X 1024 átomos
3- Calcule los átomos de Cobre que están presentes en 30 g de Sulfato cúprico. R: 1.13 X 1023 átomos
4- Determine los gramos de Oxígeno presentes en 196 g de Ácido sulfúrico. R: 128 g
5- ¿ Cuál es la masa en gramos presente en 1 átomo de Azufre ? R: 5.33 X 10 – 23 gramos.
B- Estequiometría Química
1- Dada la ecuación:
Óxido manganoso (s) + Ácido clorhídrico (ac) ------------- Cloruro hipomanganoso (ac) + Cloro libre + Agua ( L )
a- Calcule los dm3 de Cloro libre a C.N. preparados a partir de 20.0 g del reactivo-agente reductor de la reacción.
b- Si en esta reacción se obtuvieron solamente 2.67 X 10 3 cm3 de Cloro (g); calcule el % de rendimiento de la
reacción. R: a - 3.11 dm3 b - 85.85 %
2- El Amoníaco (g) reacciona con Oxígeno (g) para producir Óxido de nitrógeno (II) (g) y Agua (g).
A partir de 85.15 g del hidruro : a- ¿ Cuántos gramos de Agua se producen ? b- Determine las moles de Oxígeno
consumidas. c- Calcule las moléculas del óxido no metálico producido. d- Si realmente se obtienen 152.06 g del
óxido no metálico al 97 % de pureza; ¿ cuál es el % de rendimiento de la reacción ?.
R : a- 135.15 g b- 6. 25 moles c- 3. 01 x10 24 moléculas d- 98.38 %
3- Se descomponen por el calor 16.25 g de Clorato de potasio (s) con una pureza del 80 % de pureza; a- Calcular la
masa en gramos del gas producido. b- Si el gas producido ocupa un volumen de 3.94 L bajo condiciones de
300 ° K ; Determine la presión del gas en unidad Torr. R : a- 5.11 g b- 760 Torr
(Nota: Calcule primero la masa pura de la sustancia en base al % dado )
4- ¿Cuántas moles de hidróxido de sodio se requieren para neutralizar completamente 100 g de Ácido sulfúrico ?
R: 2.04 moles
5- ¿Cuántas moléculas de Metano (g) se producirán cuando se preparan 0.200 g de Hidróxido de aluminio a partir de la
reacción de Carburo de aluminio (s) con agua ( L) ? R : 1.16 x 10 21 moléculas
6- Determine los gramos de Oxígeno (g) que se obtienen por la descomposición de 100 g de Peróxido de calcio (s).
b- Si se obtienen realmente 23.62 g del no metal (g) al 88.70 % de pureza; determine el % de rendimiento del
producto generado. R: a- 22.22 g b- 94.29 %
7- Evaluar los dm3 de Oxígeno (g) en C.N. que se utilizan en la combustión completa (Reacción con Oxígeno) de 150 g
de Propano (g) (C3H8) al 97 % de pureza en masa . R: 370.36 dm3
C- REACTIVO LIMITANTE
1- Si 50.0 g de Carbonato de calcio (s) reaccionan con 35.0 g de Ácido fosfórico (ac) (Comparar con Producto: gramos
de la Oxosal), calcule; a) El reactivo limitante b) Los gramos de la oxosal que se producen c) La masa del reactivo
en exceso que queda al final de la reacción d) El % de rendimiento de la reacción si realmente se obtienen 53.89 g
de la oxosal al 90 % de pureza en masa. e) Las moléculas de agua que se producen f) Los átomos totales de
Oxígeno en el agua producida en la reacción. R. a - Carbonato de calcio b - 51.67g c - 2.352 g
d - 94 % e- XXXXXX f- XXXXXXX
2- Bajo C.N 79.8 litros de Hidrógeno (g) reaccionan en un recipiente con 24.5 litros de Nitrógeno (g) (Comparar con
Producto: Moléculas del Hidruro no metálico), calcular: a) El reactivo limitante b) Las moléculas del hidruro no
metálico (g) formado c) Determine las moles del reactivo en exceso que se obtienen al final de la reacción.
d) Si realmente se obtienen 1.123 X 10 24 moléculas del hidruro al 96 % de pureza en masa ; ¿cuál es el % de
rendimiento de la reacción ?. R. a - Nitrógeno b - 1.32 X 10 24 c - 0.28mol d - 82 %
3- Se dejó que una muestra de 16.5 g de Óxido cromoso (s) reaccione con 8.20 g de Aluminio (s). (Comparar con
Producto: gramos del metal ); Calcule: a) El reactivo limitante b) Los gramos de Cromo (s) que se pueden
producir c) Las moles de reactivo en exceso que quedan al terminar la reacción d) El % rendimiento de la
reacción si se obtienen realmente 10.9 g de Cromo. R. a - Óxido cromoso b = 11.3 g c - 0.086 mol
d - 96.5 %
PROBLEMAS CARIÑOSOS
A- Estequiometría Química
1- Una muestra de Hierro (s) reacciona con suficiente Ácido clorhídrico (ac). Determine ; a- ¿ Cuál es la masa del gas
obtenido en la reacción a partir de 11.17 g del reactivo - agente reductor ? b- Calcule el % de rendimiento de la
reacción si realmente se obtienen 0.382 g del gas al 91.70 % de pureza ? R: a- 0.40g b- 87.5 %
(Nota: Oxidación –Pierde Electrones- Aumento del NUMOX- Agente Reductor.
Reducción –Gana electrones- Disminuye el NUMOX- Agente Oxidante )
2- Se determinó en un análisis; que por el proceso de combustión al quemar 0.1005 g de Mentol (compuesto a base
de C, H, O ) , se produce : 0.2829 g de Dióxido de carbono y 0.1159 g de Agua. Si la masa molar del Mentol es de
156 g/mol ; determine : a- La Fórmula Empírica b- La Fórmula verdadera R: a- (C10H20O)n b- C10H20O
(Nota: Calcular primero las masas de Carbono, Hidrógeno y Oxígeno en el compuesto Original; posteriormente
determinar las moles de cada elemento.)
3- Se hace reaccionar Al (s) con Ácido clorhídrico (ac). El Hidrógeno obtenido a partir de esta reacción se hace pasar
por una muestra de Óxido cúprico (s), logrando así la separación del Cobre metálico sólido. ¿Cuántos gramos de
cobre metálico se obtendrán cuando 16. 64 g de Aluminio (s) se hacen reaccionar con el hidrácido?. R : 58.80 g
(Nota: Hacer ecuaciones de reacciones parciales por cada etapa. Luego Sumar ambas etapas y obtener una sola
ecuación)
B- REACTIVO LIMITANTE
1- Durante la I Guerra Mundial se empleó la sustancia Fosfina (g), como gas venenoso contra las tropas enemigas
aliadas en las trincheras. Este gas junto con el Hidróxido de sodio como producto secundario, se obtienen por la
reacción que se da al disolver el Fosfuro de sodio (s) en Agua (L). Si disolvemos 150 g de la sal en 250 ml de
Agua (L) (Comparar con Producto: gramos del Hidruro no metálico ); determine para esta reacción: a) El reactivo
limitante b) Los gramos de agua que reaccionan con toda la sal presente c) El rendimiento teórico (cantidad) de
Fosfina en gramos d) Si se obtienen 46 g de Fosfina en esta reacción , ¿ cuál es el % de rendimiento de la
reacción ? e) Las moléculas de la base o Hidróxido producida. f) Los átomos TOTALES de los elementos que
forman la base producida.
R: a- Fosfuro de sodio b- 81g c- 51g d- 90.20 % e- XXXXX f- XXXXXX
Para descargar el documento
Dale click aqui
Suscribirse a:
Entradas (Atom)