Para descargar el documento original:
Click Aquí
PRÁCTICA DE QUÍMICA 12° ESTEQUIOMETRÍA DE SOLUCIONES
1. En la titulación de 30.00 ml de solución de Hidróxido de sodio de concentración desconocida, se necesitaron 45.20 ml de Ácido clorhídrico 0.1 M para neutralizar la solución básica.
a) Calcule la M de la solución básica
b) Calcule la N de la solución básica
R: a) 0.151 M b) 0.151 N
2. El Carbonato de sodio se usa como patrón para determinar la concentración de los ácidos. Si se disuelven en agua 1.95 g de Carbonato de sodio puro y la solución se titula hasta completa neutralización. con 35.6 ml de solución acuosa de Ácido clorhídrico cuya Densidad de solución es 1.32 g/ml. Calcular para la solución de Ácido clorhídrico:
a) M del Ácido clorhídrico
b) m del Ácido clorhídrico
c) N del ácido
d) % P/P del ácido
e) % P/V del ácido
f) X de los componentes de la solución ácida
R: a) 1.03 M b) 0.806 m c) 1.03 N d) 2.81 % m/m e) 3.71 % m/v
f) 0.986 , 0.0143
3. El Amoniaco de uso casero es una solución diluida de Amoniaco gaseoso en agua. Al titular 2.00 ml de Amoníaco se necesitan 34.9 ml de Ácido clorhídrico 0.110 M para neutralizar la solución de Amoniaco. Si la densidad de la solución de Amoníaco es de 0.985 g/ml, determine:
a) M de la solución de Amoníaco
b) m de la solución de Amoníaco
c) % m/m
d) % m/v
R: a) 1.92 M b) 2.02 m c) 3.31 % m/m d) 3.26 % m/v
4. En la titulación de 34.50 ml de solución de Hidróxido de sodio de concentración desconocida se necesitaron 27.50 ml de Tetraoxosulfato (VI) de hidrógeno 0.1 N para neutralizar la solución básica. Determinar:
a) N de la solución de hidróxido
b) M de la solución básica
R: a) 7.97 X 10- 2 N b) ) 7.97 X 10- 2 M
5. ¿Qué volumen en ml de solución de Ácido clorhídrico 0.10 M se requieren para neutralizar 25.0 ml de una solución 0.35 M de Hidróxido de aluminio?
R: 262.5 ml
6. ¿Qué volumen de una solución Trioxonitrato (V) de hidrógeno de 6 N se requiere para neutralizar 6 ml de una solución basica 4 N de sodio?
R: 4 ml
7. 25 ml de una solución de Ácido fosfórico con Densidad de solución = 1.102 g/ml y 20 % m/m de pureza ; neutralizan 21.5 ml de Hidróxido de calcio:
a) ¿Cuál es la M de Hidróxido de calcio?
b) La N de Hidróxido de calcio
R: a) 3.92 M b) 7.83 N
8. Determina la masa en gramos de Carbonato de sodio que reacciona con 22.4 cm3 de Ácido nítrico 0.525 N
R: 0.623 g
9. Calcular los gramos de Magnesio que se disuelven en 285 ml de Ácido sulfúrico 0.1 N
R: 0.342 g
10. ¿Cuántos cm3 de Óxido carbónico a Condiciones Normales (TPN) se desprenden por acción de 100 ml de Ácido clorhídrico 2.0 N sobre Trioxocarbonato (IV) d e calcio?
R: 2240 cm3
Páginas
CADA Trabajo tiene un link de descarga al principio o al final del contenido
lunes, 23 de agosto de 2010
martes, 10 de agosto de 2010
DILUCIÓN DE SOLUCIONES I PARTE
Para descargar el archivo original:
Click Aqui
COLEGIO DE LA SALLE
LABORATORIO DE QUÍMICA 12 º
DILUCIÓN DE SOLUCIONES I PARTE
NOMBRE: _________________________________________________ GRADO: 12 º __________ Nº LISTA: __________
Materiales: Probeta, Matraz aforado (Volumétrico), Papel toalla .
Reactivos: Vinagre Comercial ; Alcohol comercial
NOTA: VINAGRE (Solución de Ácido Acético – HC2 H3 O2) 4.00 % M / V) ;
ETANOL (C2 H 5 OH) 70 % V / V; DENSIDAD ETANOL: 0.80 g/mL) .
RECOMENDACIONES PARA PREPARAR LAS DILUCIONES A PARTIR DE SOLUCIONES COMERCIALES
1- Calcular el volumen (alícuota) de solución comercial (PATRÓN) que se necesita para preparar la solución diluida.
2- Medir EN UNA PROBETA el volumen (alícuota) necesario de la solución comercial (PATRÓN).
3- Verter desde la probeta la alícuota de solución comercial (PATRÓN) EN EL Matraz Aforado.
4- Completar el volumen de solución adicionando DIRECTAMENTE AGUA DEL GRIFO en el matraz hasta llegar a la línea del aforo.
5- El Agua NO hay que medirla con la probeta puesto que el Volumen en el matraz aforado ya está establecido al llegar la solución a la línea de aforo.
6- Recuerde que el volumen de aforo se alcanza cuando el menisco de la solución (Líquido) está encima o sobre la línea de aforo.
I PARTE: PREPARACIÓN DE 250 mL DE UNA SOLUCIÓN ACUOSA AL 0.70 % M/V DE ÁCIDO ACÉTICO A PARTIR DE UNA SOLUCIÓN DE VINAGRE COMERCIAL AL 4. 00 % M/V.
PREGUNTAS RESPUESTAS PREGUNTAS RESPUESTAS
% M/V de la Solución COMERCIAL (PATRÓN) de Ácido Acético. % M/V de la Solución de Ácido Acético preparada (DILUIDA).
mL de la Alícuota de Solución Comercial (Patrón) de Ácido Acético. M de la Solución COMERCIAL (PATRÓN) de Ácido Acético
mL de Solución final (Diluida) de Ácido Acético. M de la Solución Final (Diluida )de Ácido Acético
mL de Agua (Calculado). NO MEDIRLO con Probeta.
N de la Solución Final
(Diluida )de Ácido Acético
CÁLCULOS DE LA I PARTE DEL LABORATORIO
( TODOS LOS CÁLCULOS Y RESPUESTAS CON 4 CIFRAS ENTERAS DESPUÉS DEL PUNTO )
II PARTE: PREPARACIÓN DE 100 mL DE UNA SOLUCIÓN ACUOSA AL 10 % V/V DE ETANOL A PARTIR DE UNA SOLUCIÓN DE ETANOL COMERCIAL AL (70 º) 70. 00 % V/V.
1- PARA PREPARAR ESTA SOLUCIÓN REPITA TODO EL PROCEDIMIENTO ANTERIOR PERO SUSTITUYENDO EL VINAGRE POR ETANOL COMERCIAL.
PREGUNTAS RESPUESTAS PREGUNTAS RESPUESTAS
% V/V de la Solución COMERCIAL (PATRÓN) de Etanol. % V/V de la Solución de Etanol preparada (DILUIDA).
mL de la Alícuota de Solución Comercial (Patrón) de Etanol.
M de la Solución COMERCIAL (PATRÓN) de Etanol
mL de Solución final (Diluida) de Etanol. M de la Solución Final (Diluida ) de Etanol
mL de Agua (Calculado). NO MEDIRLO con Probeta.
m (molalidad ) de la Solución Final (Diluida ) de Etanol
CÁLCULOS DE LA II PARTE DEL LABORATORIO
( TODOS LOS CÁLCULOS Y RESPUESTAS CON 4 CIFRAS ENTERAS DESPUÉS DEL PUNTO )
Pesos Atómicos: H = 1.0; Na = 23; K = 39; Rb = 55 ; Mg = 24; Ca = 40; Ba = 137; B = 11 ; Al =27 ; C = 12; Pb = 207; N = 14; P = 31; O = 16; S = 32; F = 19 ; Cl = 35; Br = 80 ; I = 127 ; Cr = 52; Fe = 56; Co = 59 ; Ni = 59; Cu = 64; Au = 197; Ag = 108 ; Mn = 55
Click Aqui
COLEGIO DE LA SALLE
LABORATORIO DE QUÍMICA 12 º
DILUCIÓN DE SOLUCIONES I PARTE
NOMBRE: _________________________________________________ GRADO: 12 º __________ Nº LISTA: __________
Materiales: Probeta, Matraz aforado (Volumétrico), Papel toalla .
Reactivos: Vinagre Comercial ; Alcohol comercial
NOTA: VINAGRE (Solución de Ácido Acético – HC2 H3 O2) 4.00 % M / V) ;
ETANOL (C2 H 5 OH) 70 % V / V; DENSIDAD ETANOL: 0.80 g/mL) .
RECOMENDACIONES PARA PREPARAR LAS DILUCIONES A PARTIR DE SOLUCIONES COMERCIALES
1- Calcular el volumen (alícuota) de solución comercial (PATRÓN) que se necesita para preparar la solución diluida.
2- Medir EN UNA PROBETA el volumen (alícuota) necesario de la solución comercial (PATRÓN).
3- Verter desde la probeta la alícuota de solución comercial (PATRÓN) EN EL Matraz Aforado.
4- Completar el volumen de solución adicionando DIRECTAMENTE AGUA DEL GRIFO en el matraz hasta llegar a la línea del aforo.
5- El Agua NO hay que medirla con la probeta puesto que el Volumen en el matraz aforado ya está establecido al llegar la solución a la línea de aforo.
6- Recuerde que el volumen de aforo se alcanza cuando el menisco de la solución (Líquido) está encima o sobre la línea de aforo.
I PARTE: PREPARACIÓN DE 250 mL DE UNA SOLUCIÓN ACUOSA AL 0.70 % M/V DE ÁCIDO ACÉTICO A PARTIR DE UNA SOLUCIÓN DE VINAGRE COMERCIAL AL 4. 00 % M/V.
PREGUNTAS RESPUESTAS PREGUNTAS RESPUESTAS
% M/V de la Solución COMERCIAL (PATRÓN) de Ácido Acético. % M/V de la Solución de Ácido Acético preparada (DILUIDA).
mL de la Alícuota de Solución Comercial (Patrón) de Ácido Acético. M de la Solución COMERCIAL (PATRÓN) de Ácido Acético
mL de Solución final (Diluida) de Ácido Acético. M de la Solución Final (Diluida )de Ácido Acético
mL de Agua (Calculado). NO MEDIRLO con Probeta.
N de la Solución Final
(Diluida )de Ácido Acético
CÁLCULOS DE LA I PARTE DEL LABORATORIO
( TODOS LOS CÁLCULOS Y RESPUESTAS CON 4 CIFRAS ENTERAS DESPUÉS DEL PUNTO )
II PARTE: PREPARACIÓN DE 100 mL DE UNA SOLUCIÓN ACUOSA AL 10 % V/V DE ETANOL A PARTIR DE UNA SOLUCIÓN DE ETANOL COMERCIAL AL (70 º) 70. 00 % V/V.
1- PARA PREPARAR ESTA SOLUCIÓN REPITA TODO EL PROCEDIMIENTO ANTERIOR PERO SUSTITUYENDO EL VINAGRE POR ETANOL COMERCIAL.
PREGUNTAS RESPUESTAS PREGUNTAS RESPUESTAS
% V/V de la Solución COMERCIAL (PATRÓN) de Etanol. % V/V de la Solución de Etanol preparada (DILUIDA).
mL de la Alícuota de Solución Comercial (Patrón) de Etanol.
M de la Solución COMERCIAL (PATRÓN) de Etanol
mL de Solución final (Diluida) de Etanol. M de la Solución Final (Diluida ) de Etanol
mL de Agua (Calculado). NO MEDIRLO con Probeta.
m (molalidad ) de la Solución Final (Diluida ) de Etanol
CÁLCULOS DE LA II PARTE DEL LABORATORIO
( TODOS LOS CÁLCULOS Y RESPUESTAS CON 4 CIFRAS ENTERAS DESPUÉS DEL PUNTO )
Pesos Atómicos: H = 1.0; Na = 23; K = 39; Rb = 55 ; Mg = 24; Ca = 40; Ba = 137; B = 11 ; Al =27 ; C = 12; Pb = 207; N = 14; P = 31; O = 16; S = 32; F = 19 ; Cl = 35; Br = 80 ; I = 127 ; Cr = 52; Fe = 56; Co = 59 ; Ni = 59; Cu = 64; Au = 197; Ag = 108 ; Mn = 55
lunes, 28 de junio de 2010
lunes, 24 de mayo de 2010
PLANIFICACIÓN DE ACTIVIDADES DE LA SEMANA DE LA CIENCIA QUÍMICA 12 °
Para descargar el documento original
Click aquí
COLEGIO DE LA SALLE
DEPARTAMENTO DE CIENCIAS NATURALES
PLANIFICACIÓN DE ACTIVIDADES DE LA SEMANA DE LA CIENCIA QUÍMICA 12 °
DEL 7 DE JUNIO AL 11 DE JUNIO DE 2010
PROFESOR: SADAY E. ZAPATA L . II BIMESTRE
TEMA Nº 1: LOS PLAGUICIDAS: SU IMPACTO EN LA PRODUCCIÓN AGRÍCOLA, EN
LA BIODIVERSIDAD Y EN LA SALUD.
MODALIDADES PARA EVALUACIÓN DEL GRUPO:
- Charlas
- Trabajo Escrito para Biblioteca
- Graffitis o Colage de Advertencia o Denuncias Tamaño Mural para la pared del pasillo
- Mensajes de Advertencia o Denuncia en Tela para colgar del Balcón
- Ambientación del Salón (incluye la confección de Recordatorios).
NOTA: CUALQUIER MODALIDAD ASIGNADA DEBE PRESENTARSE CON LA MÁS ALTA CALIDAD Y ESMERO PUESTO QUE CONSTITUIRÁ UNA EVALUACIÓN PARCIAL Y 10 PUNTOS DE UN QUIZ.
CONTENIDOS A DESARROLLAR:
- Concepto de Plaga
- Concepto de plaguicida (Uso Fitosanitario y Zoosanitario)
- Tipos de Plaguicidas
1- De acuerdo a la Plaga que Controlan
1-1- Insecticidas, Acaricida
1-2- Fungicidas, Herbicidas
1-3- Nematicidas, Molusquicidas
1-4- Rodenticidas, Otros...
2- De acuerdo a su origen
1-5- Orgánicos o Naturales
1-6- Sintéticos (Clorados, Fosforados, Carbamatos, Piretroides, Otros..)
NOTA: En esta Parte se deben presentar en las Diapositivas las imágenes de las Estructuras Químicas de estos Grupos. Hacer énfasis en sus Propiedades Físicas y Químicas, Su Solubilidad en agua. Investigar los Grupos Funcionales (Ver Texto) presentes en las estructuras de estas Moléculas Orgánicas.
- Sistemas de Protección al manipular los Plaguicidas
- Manejo de los Envases Vacíos de Plaguicidas
- Medidas para almacenar los Plaguicidas.
- Síntomas por intoxicaciones con Plaguicidas
- Efectos en la Salud del hombre por el manejo incorrecto de Plaguicidas
- Persistencia (Vida media) de los Plaguicidas en los Ecosistemas
1- Bioacumulación
2- Biomagnificación
- Presentación de Cuadros con la Clasificación de los Plaguicidas y ejemplos de
los Productos Comerciales que los contienen.
- Presentar una lista de los Productos Plaguicidas Comerciales que venden en el mercado y para qué sirven. Revisar o Consultar en: Hogares, Supermercados, Tiendas, Farmacias, MELO, Otros…
- Presentar una lista de los Productos Plaguicidas Comerciales que utiliza el Personal de Mantenimiento en el Colegio y para qué lo usan.
- Presentar VIDEOS- DOCUMENTALES que consigan sobre el Tema.
NOTA: Los Contenidos aquí presentados se desarrollarán, por un Grupo de estudiantes, en las Modalidades ya mencionadas.
Deben apoyarse en las páginas de INTERNET sugeridas, aunque pueden complementar con muchas otras más.
Presentar Videos- Documentales que consigan sobre el Tema.
(Conceptos, Tipos de Plaguicidas)
http://www.bvsde.paho.org/bvstox/fulltext/ineldo.pdf
http://www.plagasydesinfeccion.com/plaguicidas/
http://www.plagasydesinfeccion.com/plaguicidas/plaguicidas-organicos.html
http://www.plagasydesinfeccion.com/plaguicidas/plaguicidas-sinteticos.html
(Manejo de Plaguicidas)
http://www.cipotato.org/publications/pdf/003861.pdf
(Persistencia en el Ambiente de los Plaguicidas)
http://www.caata.org/persistencia_y_bioacumulacin_de_plaguicidas.html
http://www.istas.net/portada/cops10.pdf
http://www.semarnat.gob.mx/gestionambiental/Materiales%20y%20Actividades%20Riesgosas/plafest/riesgos.pdf
(Efectos en la salud del Hombre Por la acción de los Plaguicidas)
http://www.mspas.gob.sv/regulacion/pdf/guia/Guia%20patalog_FH10_6_Adolescentes.pdf
(Modelos de Ayuda para los Cuadros)
http://www.biol.unlp.edu.ar/toxicologia/seminarios/parte_2/plaguicidas.html
http://www.mspas.gob.sv/regulacion/pdf/guia/Guia%20patalog_FH10_6_Adolescentes.pdf
(Ejemplos para las Opciones Graffiti)
http://revista-amauta.org/tag/ecologia-social/page/10/
(Ejemplos para las Opciones Colage)
http://mi-estrella-de-mar.blogspot.com/2010_03_01_archive.html
Click aquí
COLEGIO DE LA SALLE
DEPARTAMENTO DE CIENCIAS NATURALES
PLANIFICACIÓN DE ACTIVIDADES DE LA SEMANA DE LA CIENCIA QUÍMICA 12 °
DEL 7 DE JUNIO AL 11 DE JUNIO DE 2010
PROFESOR: SADAY E. ZAPATA L . II BIMESTRE
TEMA Nº 1: LOS PLAGUICIDAS: SU IMPACTO EN LA PRODUCCIÓN AGRÍCOLA, EN
LA BIODIVERSIDAD Y EN LA SALUD.
MODALIDADES PARA EVALUACIÓN DEL GRUPO:
- Charlas
- Trabajo Escrito para Biblioteca
- Graffitis o Colage de Advertencia o Denuncias Tamaño Mural para la pared del pasillo
- Mensajes de Advertencia o Denuncia en Tela para colgar del Balcón
- Ambientación del Salón (incluye la confección de Recordatorios).
NOTA: CUALQUIER MODALIDAD ASIGNADA DEBE PRESENTARSE CON LA MÁS ALTA CALIDAD Y ESMERO PUESTO QUE CONSTITUIRÁ UNA EVALUACIÓN PARCIAL Y 10 PUNTOS DE UN QUIZ.
CONTENIDOS A DESARROLLAR:
- Concepto de Plaga
- Concepto de plaguicida (Uso Fitosanitario y Zoosanitario)
- Tipos de Plaguicidas
1- De acuerdo a la Plaga que Controlan
1-1- Insecticidas, Acaricida
1-2- Fungicidas, Herbicidas
1-3- Nematicidas, Molusquicidas
1-4- Rodenticidas, Otros...
2- De acuerdo a su origen
1-5- Orgánicos o Naturales
1-6- Sintéticos (Clorados, Fosforados, Carbamatos, Piretroides, Otros..)
NOTA: En esta Parte se deben presentar en las Diapositivas las imágenes de las Estructuras Químicas de estos Grupos. Hacer énfasis en sus Propiedades Físicas y Químicas, Su Solubilidad en agua. Investigar los Grupos Funcionales (Ver Texto) presentes en las estructuras de estas Moléculas Orgánicas.
- Sistemas de Protección al manipular los Plaguicidas
- Manejo de los Envases Vacíos de Plaguicidas
- Medidas para almacenar los Plaguicidas.
- Síntomas por intoxicaciones con Plaguicidas
- Efectos en la Salud del hombre por el manejo incorrecto de Plaguicidas
- Persistencia (Vida media) de los Plaguicidas en los Ecosistemas
1- Bioacumulación
2- Biomagnificación
- Presentación de Cuadros con la Clasificación de los Plaguicidas y ejemplos de
los Productos Comerciales que los contienen.
- Presentar una lista de los Productos Plaguicidas Comerciales que venden en el mercado y para qué sirven. Revisar o Consultar en: Hogares, Supermercados, Tiendas, Farmacias, MELO, Otros…
- Presentar una lista de los Productos Plaguicidas Comerciales que utiliza el Personal de Mantenimiento en el Colegio y para qué lo usan.
- Presentar VIDEOS- DOCUMENTALES que consigan sobre el Tema.
NOTA: Los Contenidos aquí presentados se desarrollarán, por un Grupo de estudiantes, en las Modalidades ya mencionadas.
Deben apoyarse en las páginas de INTERNET sugeridas, aunque pueden complementar con muchas otras más.
Presentar Videos- Documentales que consigan sobre el Tema.
(Conceptos, Tipos de Plaguicidas)
http://www.bvsde.paho.org/bvstox/fulltext/ineldo.pdf
http://www.plagasydesinfeccion.com/plaguicidas/
http://www.plagasydesinfeccion.com/plaguicidas/plaguicidas-organicos.html
http://www.plagasydesinfeccion.com/plaguicidas/plaguicidas-sinteticos.html
(Manejo de Plaguicidas)
http://www.cipotato.org/publications/pdf/003861.pdf
(Persistencia en el Ambiente de los Plaguicidas)
http://www.caata.org/persistencia_y_bioacumulacin_de_plaguicidas.html
http://www.istas.net/portada/cops10.pdf
http://www.semarnat.gob.mx/gestionambiental/Materiales%20y%20Actividades%20Riesgosas/plafest/riesgos.pdf
(Efectos en la salud del Hombre Por la acción de los Plaguicidas)
http://www.mspas.gob.sv/regulacion/pdf/guia/Guia%20patalog_FH10_6_Adolescentes.pdf
(Modelos de Ayuda para los Cuadros)
http://www.biol.unlp.edu.ar/toxicologia/seminarios/parte_2/plaguicidas.html
http://www.mspas.gob.sv/regulacion/pdf/guia/Guia%20patalog_FH10_6_Adolescentes.pdf
(Ejemplos para las Opciones Graffiti)
http://revista-amauta.org/tag/ecologia-social/page/10/
(Ejemplos para las Opciones Colage)
http://mi-estrella-de-mar.blogspot.com/2010_03_01_archive.html
PRACTICA DE MOLARIDAD Y MOLALIDAD
Para descargar el documento original
Click aquí
COLEGIO DE LA SALLE
PRÁCTICA DE QUÍMICA 12° TEMA: MOLARIDAD Y MOLALIDAD
MOLARIDAD
1. Calcule la Molaridad de una solución acuosa de Cloruro de sodio que contiene 284 g de la sal binaria en
2.20 X10 3 mL de solución. R: 2.23 M
2. Determine los gramos de Tris - Sulfato (VI) de dialuminio, que se necesitan para preparar 2.20 X10 – 3 m 3 de una solución acuosa al 1.20 M del compuesto ternario. R: 902.88 g
3. Calcular el volumen en L de una solución 6.00 M de Hidróxido de sodio que se requieren para obtener 410 g de la base. R: 1.71 L
4. Una solución acuosa de Hidróxido de sodio es 4.00 M y tiene una densidad de solución de 1.40 X10 – 3 Kg/mL. ¿Cuál es la concentración de la solución en términos de % m/m de la base? R: 11.43 % m/m
5. En cuántos mL de solución deben disolverse 40 mg de Dicromato (VI) de dipotasio para preparar una solución 1.36 X10 – 2 M de esta Oxosal. R: 10 mL
6. Si al disolver 25.0 g de un soluto desconocido en 2.60 X10 – 3 m3 de solución se obtiene una solución 0.120 M. ¿Cuál es el peso molecular del soluto expresado en g /mol ? R: 80.13 g /mol
7. Calcule la M de una solución Gas-Líquido en donde disolvemos 2.39 X 10 5 mL del gas Amoníaco a T.P.N. en 3.58 X10 3 mL de solución acuosa. R: 2.98 M
8. ¿ Qué volumen en cm3 de una solución 0,60 M se pueden preparar con 46,50 g de Fosfato de calcio ?
R: 250 cm3
MOLALIDAD
9. Calcule los gramos de Cloruro de sodio que se necesitan para preparar 0.520 Kg de una solución 2.00 m de la sal binaria en agua. R: 54.0 g
10. Determine la molalidad de una solución de Glicerina (C3H8O3) que contiene 32.7 g de Glicerina en 100 mL de agua. R: 3.55 m
11. Determine los gramos de Agua que se deben añadir a 1.80 g de Metanol (CH3OH) para obtener una solución al 0.10 m R: 562.5 g
12. Se prepara una solución disolviendo 8.653 X10 4 mg de Carbonato (IV) de disodio en Agua, en un matraz volumétrico de 1000 ml, añadiéndole Agua hasta la marca de aforo y luego mezclando. La densidad de la solución es 1.381 g/ml. Con esta información determine la m de la solución. R: 0.63 m
13. ¿Cuántos gramos de Sulfato (VI) de disodio se deben disolver en un cuarto de Litro de agua para preparar una solución 0.80 m ?. R: 28.4 g
14. Una solución acuosa de Etanol (C2H5 OH) es 1.54 m; ¿ Cuántos gramos de Etanol hay disueltos en 2.50 dm 3 de Agua ?. R: 177.1 g
15. ¿ Cuántos cm3 del solvente de nombre Benceno (C6H6) de densidad 0,88g/cm3 hay que añadir para disolver
32.0 g de Naftaleno (C10H8 ) para que la solución sea 0,58m. Resp: 489,81cm3.
PROBLEMAS CARIÑOSITOS DE MOLARIDAD Y MOLALIDAD COMBINADOS
16. Una solución acuosa diluida presenta una concentración de 6.50 X10 – 2 % m/m del ión Sulfato. Basado en los criterios de concentración PPM, determine:
a) EL % m/v del ión en la solución b) La masa en gramos del ión en 1.00 L de la solución acuosa
c) La concentración PPM del ión en la solución d) La M de la Solución e) La Molalidad de la Solución
R: a) 6.50 X10 – 2 % m/m b) 0.650 g c) 650 PPM d) 6.77 X10 – 3 M e) 6.77 X10 – 3 m
17. Determine la M de una solución acuosa de Ácido sulfúrico que tiene una densidad de solución de
1.30 X10 3 g /L y que tiene una concentración al 32.60 % m/m del ácido. R: 4.32 M
18. En una solución acuosa de Ácido sulfhídrico cuya densidad de solución es 1.16 g/ml , la FM del ácido es de 0.15. Determine la M y la m respectivamente de la solución del hidrácido. R: a) 8.57 M b) 9.80 m
19. La solubilidad de la Sacarosa en Agua a 20 ° C es 204 g / 100 g H2O. Calcule respectivamente el % m/m y la m de la solución de Sacarosa. R: a) 67.10 % m/m b) 6.00 m
20. Una solución acuosa diluida contiene 1.750 X10 – 2 PPM del ión Ferrocianuro. Basado en estos datos determinar: a) El % m/v del ión en la solución b) La M de la solución c) m de la solución
d) FM soluto e ) % Molar del soluto
R: a) 1.75 X10 – 6 % m/v b) 8.25 X10 – 8 M c) 8.25 X10 – 8 m d) FM soluto: 1.48 X10 – 9 e) 1.48 X10 – 7 %
21. Cuál es la M y la m respectivamente de una solución de Cloruro férrico que tiene una densidad de solución de 1.29 g/cm3 y una pureza del 30.0 % . R: a) 2.40 M b) 2.66 m
22. Una solución contiene 20.0 g de Ácido acético en 0.250 L de Agua. Con esta información determine: a) La m de la solución b) La fracción molar del Solvente c) FM soluto de la solución.
R: a) 1.32 (1.36 ) m ???? b) FM solvente: 0.976 Solvente c) FM soluto: 0.024 Soluto
23. Una solución acuosa de Ácido dicrómico tiene una concentración de 40 % m/v y una densidad de solución de de 1.20 g/ml. Calcular para esta solución: a) FM del ácido b) FM del agua c) M de la Solución d) m de la solución R: a) 0.039 b) 0.960 c) 1.83 d) 2.29
24. Una solución acuosa de Hidróxido de potasio con densidad de solución de 1.48 g/ml tiene una pureza del
37.5 % . Determina respectivamente la concentración Molar y molal para esta solución básica.
R: a) 9.91 M b) 10.56 m
25. En una solución acuosa de Cloruro de sodio con densidad de 1.25 g/ml, el % Molar de la sal es 36 %. Calcular para esta solución: a) % m/m de la sal b) % m/v de la sal c) La M de la solución d) La m de la solución R: a) 64.44 % m/m b) 80.56 % m/v c) 13.89 M d) 31.25 m
26. Se disuelven 78.20 g de Glicerina (C3H8O3) en 350cm 3 de Benceno (C6H6) cuya densidad es 0.88 g/mL. Con esta información determinar: a) molalidad de la solución B) % m/m de la solución C) FM Soluto D) FM Solvente. R: a) 2.76 m b) 20.25 % m/m c) FM Soluto 0.18 d) FM Solvente 0.82
27. Calcular respectivamente las fracciones molares de soluto y solvente en una disolución acuosa 4.50 molal de Cromato de sodio. R: FM soluto = 0.07 FM Solvente = 0.93
28. ¿ Cuántos gramos de un soluto de masa molar 60 g/mol deben añadirse a 270 mL de agua para obtener una disolución cuya FM de solvente sea 0.92 ?. b) Determinar además la molalidad de la solución.
R : a) 78.26 g de soluto b) 4.81 m
29. Una disolución contiene 57.50 cm3 de Etanol (C2H5OH) de densidad 0.80 g/cm3 y 600 cm3 de Benceno (C6H6) de densidad 0.90 g/cm3. Determinar para la solución final: a) La molalidad b) % m/v
C) % m/m D) % v/v R : a) 1,85 m b) 7 .00 % m/v c) 7,85 % m/m d) 8,74 % v/v
30. 56.70 g de Cromato de sodio se disuelven en suficiente cantidad de Agua hasta obtener 700cm 3 de una solución de densidad de solución 1,12 g/mL. Calcular respectivamente para esta solución la m y M.
R: a) 0,48 m b) 0,50M
Click aquí
COLEGIO DE LA SALLE
PRÁCTICA DE QUÍMICA 12° TEMA: MOLARIDAD Y MOLALIDAD
MOLARIDAD
1. Calcule la Molaridad de una solución acuosa de Cloruro de sodio que contiene 284 g de la sal binaria en
2.20 X10 3 mL de solución. R: 2.23 M
2. Determine los gramos de Tris - Sulfato (VI) de dialuminio, que se necesitan para preparar 2.20 X10 – 3 m 3 de una solución acuosa al 1.20 M del compuesto ternario. R: 902.88 g
3. Calcular el volumen en L de una solución 6.00 M de Hidróxido de sodio que se requieren para obtener 410 g de la base. R: 1.71 L
4. Una solución acuosa de Hidróxido de sodio es 4.00 M y tiene una densidad de solución de 1.40 X10 – 3 Kg/mL. ¿Cuál es la concentración de la solución en términos de % m/m de la base? R: 11.43 % m/m
5. En cuántos mL de solución deben disolverse 40 mg de Dicromato (VI) de dipotasio para preparar una solución 1.36 X10 – 2 M de esta Oxosal. R: 10 mL
6. Si al disolver 25.0 g de un soluto desconocido en 2.60 X10 – 3 m3 de solución se obtiene una solución 0.120 M. ¿Cuál es el peso molecular del soluto expresado en g /mol ? R: 80.13 g /mol
7. Calcule la M de una solución Gas-Líquido en donde disolvemos 2.39 X 10 5 mL del gas Amoníaco a T.P.N. en 3.58 X10 3 mL de solución acuosa. R: 2.98 M
8. ¿ Qué volumen en cm3 de una solución 0,60 M se pueden preparar con 46,50 g de Fosfato de calcio ?
R: 250 cm3
MOLALIDAD
9. Calcule los gramos de Cloruro de sodio que se necesitan para preparar 0.520 Kg de una solución 2.00 m de la sal binaria en agua. R: 54.0 g
10. Determine la molalidad de una solución de Glicerina (C3H8O3) que contiene 32.7 g de Glicerina en 100 mL de agua. R: 3.55 m
11. Determine los gramos de Agua que se deben añadir a 1.80 g de Metanol (CH3OH) para obtener una solución al 0.10 m R: 562.5 g
12. Se prepara una solución disolviendo 8.653 X10 4 mg de Carbonato (IV) de disodio en Agua, en un matraz volumétrico de 1000 ml, añadiéndole Agua hasta la marca de aforo y luego mezclando. La densidad de la solución es 1.381 g/ml. Con esta información determine la m de la solución. R: 0.63 m
13. ¿Cuántos gramos de Sulfato (VI) de disodio se deben disolver en un cuarto de Litro de agua para preparar una solución 0.80 m ?. R: 28.4 g
14. Una solución acuosa de Etanol (C2H5 OH) es 1.54 m; ¿ Cuántos gramos de Etanol hay disueltos en 2.50 dm 3 de Agua ?. R: 177.1 g
15. ¿ Cuántos cm3 del solvente de nombre Benceno (C6H6) de densidad 0,88g/cm3 hay que añadir para disolver
32.0 g de Naftaleno (C10H8 ) para que la solución sea 0,58m. Resp: 489,81cm3.
PROBLEMAS CARIÑOSITOS DE MOLARIDAD Y MOLALIDAD COMBINADOS
16. Una solución acuosa diluida presenta una concentración de 6.50 X10 – 2 % m/m del ión Sulfato. Basado en los criterios de concentración PPM, determine:
a) EL % m/v del ión en la solución b) La masa en gramos del ión en 1.00 L de la solución acuosa
c) La concentración PPM del ión en la solución d) La M de la Solución e) La Molalidad de la Solución
R: a) 6.50 X10 – 2 % m/m b) 0.650 g c) 650 PPM d) 6.77 X10 – 3 M e) 6.77 X10 – 3 m
17. Determine la M de una solución acuosa de Ácido sulfúrico que tiene una densidad de solución de
1.30 X10 3 g /L y que tiene una concentración al 32.60 % m/m del ácido. R: 4.32 M
18. En una solución acuosa de Ácido sulfhídrico cuya densidad de solución es 1.16 g/ml , la FM del ácido es de 0.15. Determine la M y la m respectivamente de la solución del hidrácido. R: a) 8.57 M b) 9.80 m
19. La solubilidad de la Sacarosa en Agua a 20 ° C es 204 g / 100 g H2O. Calcule respectivamente el % m/m y la m de la solución de Sacarosa. R: a) 67.10 % m/m b) 6.00 m
20. Una solución acuosa diluida contiene 1.750 X10 – 2 PPM del ión Ferrocianuro. Basado en estos datos determinar: a) El % m/v del ión en la solución b) La M de la solución c) m de la solución
d) FM soluto e ) % Molar del soluto
R: a) 1.75 X10 – 6 % m/v b) 8.25 X10 – 8 M c) 8.25 X10 – 8 m d) FM soluto: 1.48 X10 – 9 e) 1.48 X10 – 7 %
21. Cuál es la M y la m respectivamente de una solución de Cloruro férrico que tiene una densidad de solución de 1.29 g/cm3 y una pureza del 30.0 % . R: a) 2.40 M b) 2.66 m
22. Una solución contiene 20.0 g de Ácido acético en 0.250 L de Agua. Con esta información determine: a) La m de la solución b) La fracción molar del Solvente c) FM soluto de la solución.
R: a) 1.32 (1.36 ) m ???? b) FM solvente: 0.976 Solvente c) FM soluto: 0.024 Soluto
23. Una solución acuosa de Ácido dicrómico tiene una concentración de 40 % m/v y una densidad de solución de de 1.20 g/ml. Calcular para esta solución: a) FM del ácido b) FM del agua c) M de la Solución d) m de la solución R: a) 0.039 b) 0.960 c) 1.83 d) 2.29
24. Una solución acuosa de Hidróxido de potasio con densidad de solución de 1.48 g/ml tiene una pureza del
37.5 % . Determina respectivamente la concentración Molar y molal para esta solución básica.
R: a) 9.91 M b) 10.56 m
25. En una solución acuosa de Cloruro de sodio con densidad de 1.25 g/ml, el % Molar de la sal es 36 %. Calcular para esta solución: a) % m/m de la sal b) % m/v de la sal c) La M de la solución d) La m de la solución R: a) 64.44 % m/m b) 80.56 % m/v c) 13.89 M d) 31.25 m
26. Se disuelven 78.20 g de Glicerina (C3H8O3) en 350cm 3 de Benceno (C6H6) cuya densidad es 0.88 g/mL. Con esta información determinar: a) molalidad de la solución B) % m/m de la solución C) FM Soluto D) FM Solvente. R: a) 2.76 m b) 20.25 % m/m c) FM Soluto 0.18 d) FM Solvente 0.82
27. Calcular respectivamente las fracciones molares de soluto y solvente en una disolución acuosa 4.50 molal de Cromato de sodio. R: FM soluto = 0.07 FM Solvente = 0.93
28. ¿ Cuántos gramos de un soluto de masa molar 60 g/mol deben añadirse a 270 mL de agua para obtener una disolución cuya FM de solvente sea 0.92 ?. b) Determinar además la molalidad de la solución.
R : a) 78.26 g de soluto b) 4.81 m
29. Una disolución contiene 57.50 cm3 de Etanol (C2H5OH) de densidad 0.80 g/cm3 y 600 cm3 de Benceno (C6H6) de densidad 0.90 g/cm3. Determinar para la solución final: a) La molalidad b) % m/v
C) % m/m D) % v/v R : a) 1,85 m b) 7 .00 % m/v c) 7,85 % m/m d) 8,74 % v/v
30. 56.70 g de Cromato de sodio se disuelven en suficiente cantidad de Agua hasta obtener 700cm 3 de una solución de densidad de solución 1,12 g/mL. Calcular respectivamente para esta solución la m y M.
R: a) 0,48 m b) 0,50M
APUNTES DE QUÍMICA ORGÁNICA
Para descargar el documento original:
Click aquí
APUNTES DE QUÍMICA ORGÁNICA
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 º
A- CLASIFICACIÓN DE LOS COMPUESTOS ORGÁNICOS
Definición de Hidrocarburos: Compuestos formados a base de Carbono e Hidrógeno en su estructura molecular , y es el esqueleto básico en la estructura molecular de los compuestos que forman las moléculas orgánicas.
Los Compuestos Orgánicos se clasifican en:
a) Hidrocarburos Alifáticos b) Hidrocarburos Aromáticos
Hidrocarburos Alifáticos
La palabra “Alifáticos ” proviene de "aliphos" que es de esta manera como se conocían las GRASAS que fueron el primer grupo de esta serie de compuestos que se estudió.
Los Hidrocarburos Alifáticos comprenden:
a) Hidrocarburos Saturados b) Hidrocarburos No Saturados
Hidrocarburos Saturados:
Son aquellos compuestos donde existe la máxima cantidad de enlaces covalentes simples entre átomos de Carbono. Los enlaces simples existentes son de tipo C– C. En estas moléculas tenemos la MAYOR cantidad de átomos de Hidrógeno que pueden unirse a los átomos de Carbono de la estructura de la molécula. En las moléculas con enlaces simples entre átomos de Carbono es donde existe MÁS cantidad de átomos de Hidrógeno presentes en la estructura.
Hidrocarburos NO Saturados:
Son aquellos compuestos donde NO existe la máxima cantidad de enlaces covalentes simples entre átomos de Carbono, ya que existen dobles y triples enlaces entre átomos de Carbono. Los enlaces existentes son de tipo
C C y C C. En estas moléculas tenemos la MENOR cantidad de átomos de Hidrógeno que pueden unirse a los átomos de Carbono, ya que cuando el Carbono se enlaza a otro átomo con enlaces dobles o triples, se va reduciendo la posibilidad de que se una con átomos de Hidrógeno. En las moléculas con enlaces triples entre átomos de Carbono es donde existe MENOS cantidad de átomos de Hidrógeno presentes en la estructura.
Por consiguiente, los Hidrocarburos Alifáticos contienen a los compuestos que según la cantidad de enlaces C – C se clasifican en Alcanos ( Enlaces simples ), Alquenos ( Enlaces dobles ) y Alquinos ( Enlaces triples ). (
Formulas Generales de los Hidrocarburos
* Alcanos : Cn H 2n + 2 * Alquenos: Cn H 2n * Alquinos: Cn H 2n – 2
Los Hidrocarburos alifáticos se dividen en:
- Hidrocarburos Lineales o de Cadena Abierta o Acíclicos
- Hidrocarburos Cíclicos , o de Cadena Cerrada o Alicíclicos
Estas dos divisiones de Hidrocarburos Alifáticos a su vez incluyen hidrocarburos Saturados y No Saturados.
Hidrocarburos Lineales: Son los de cadena lineal o en línea recta. Al escribir los nombres de estos compuestos se emplea la letra “n”. Ejemplos:
CH3 – CH2 – CH3 CH3 – CH2 – CH2 – CH3 CH3 – CH2 – CH2 – CH2 – CH2 – CH3
n – PROPANO n –BUTANO n –HEXANO
Los Hidrocarburos de Cadena abierta pueden tener ramificaciones u otras cadenas que se encuentran unidas a la estructura central. Se les llama: Hidrocarburos Ramificados.
CH3 – CH – CH2 – CH – CH2 – CH – CH2 – CH2 – CH2 – CH2 – CH3
CH3 (2º) CH2 (3º) CH – CH2 – CH2 – CH2 – CH2
CH3 CH – CH2 – CH3 CH3 (1º)
(4º)
CH3 – C – CH2 – CH3
CH3
Hidrocarburos Cíclicos: En estos hidrocarburos la cadena lineal se cierra para que se unan (enlacen) los átomos de Carbono que están EN LOS EXTREMOS de la cadena lineal. Al unirse los átomos de Carbono de los extremos de la
cadena se pierden átomos de Hidrógeno. Dependiendo del tipo de enlace formado (simple, doble, triple) con los Carbono extremos, se observa la pérdida de MÁS O MENOS átomos de Hidrógeno; dependiendo cuál sea el caso. Los Hidrocarburos Cíclicos adquieren formas geométricas que se pueden emplear al dibujar las estructuras.
CICLO PROPANO CICLO BUTANO CICLO HEXANO
CICLO PROPENO CICLO BUTENO CICLO HEXENO CICLO HEXINO
Los Hidrocarburos Cíclicos ya sean alcanos, alquenos o alquinos, poseen muy semejantes propiedades físicas y químicas que las del correspondiente hidrocarburo de cadena lineal.
Hidrocarburos Aromáticos
Hidrocarburos conformados por un compuesto característico llamado Benceno; el cual les confiere a estos Hidrocarburos un olor agradable (cerezas, duraznos y almendras) que nos ayuda a identificarlos fácilmente. El Benceno es un hidrocarburo de 6 carbonos y 6 hidrógenos (C6H6). Presenta estructura hexagonal con 3 dobles enlaces alternados. Estos dobles enlaces alternados NO ocupan una posición fija en el Benceno, por lo que constantemente los electrones de estos dobles enlaces (nube electrónica) están deslocalizados (se mueven o rotan a través de la estructura); esto conlleva a que la estructura del Benceno sea una estructura RESONANTE ( que no presentan una posición definida de sus electrones ).
Nota: El CÍRCULO en la última estructura ( letra C ) nos indica la Rotación Constante (Resonancia) de los electrones en los dobles enlaces de la Molécula de Benceno.
Los Compuestos Aromáticos se Dividen en:
a) Hidrocarburos Homocíclicos b) Hidrocarburos Heterocíclicos
- Hidrocarburos Aromáticos Homocíclicos: Son aquellos Hidrocarburos Aromáticos formados sólo por Carbono e Hidrógeno.
- Hidrocarburos Aromáticos Heterocíclicos: Estos hidrocarburos presentan Carbono, Hidrógeno y otros átomos que sustituyen al carbono dentro de la estructura, con la misma Tetravalencia o 4 enlaces del Carbono. Ejemplos: Si, Ge, Sn, Pb.
Los átomos de Carbono en las diferentes moléculas orgánicas, muchas veces deben ser clasificados según se encuentre unidos a UNO, DOS, TRES ó CUATRO átomos de Carbono. Según sea el caso los átomos de Carbono pueden ser :
a) Primarios: Unidos a UN solo átomo de Carbono. b) Secundarios: Unidos a DOS átomos de Carbono.
c) Terciarios : Unidos a TRES átomos de Carbono. d) Cuaternarios: Unidos a CUATRO átomos de Carbono.
Nota: Para referirnos a estos CUATRO tipos de átomos de Carbono observe la estructura de ejemplo ramificada presentada anteriormente y clasificada como: Hidrocarburos Ramificados. En ellas se resalta en negrita el Carbono y su clasificación según a cuántos otros átomos de Carbono están unidos ( Primarios 1º, Secundarios 2º,
Terciarios 3º, Cuaternarios 4º. )
Series Homólogas
Recibe este nombre una serie de compuestos orgánicos cuyos miembros difieren en una proporción constante de Carbono e Hidrógeno. En el caso de los Alcanos, Alquenos y Alquinos, estas familias forman tal serie homóloga, siendo la diferencia ( en el Orden Ascendente de la familia ) entre un compuesto y otro: Un Carbono y Dos Hidrógenos; es decir, un Grupo CH2.
ALCANOS (Cn H 2n + 2) ALQUENOS (Cn H 2n) ALQUINOS (Cn H 2n – 2)
C H 4
C 2 H 6 C 2 H 4 C 2 H 2
C 3 H 8 C 3 H 6 C 3 H 4
C 4 H 10 C 4 H 8 C 4 H 6
C 5 H 12 C 5 H 10 C 5 H 8
Grupos Alquilo o Radicales
Son grupos derivados de los Alcanos y que actúan como sustituyentes de las moléculas orgánicas convirtiéndolas en moléculas Ramificadas (Hidrocarburos Ramificados).
Estos grupos Alquilos, Sustituyentes o Radicales se obtienen al retirarles a los compuestos Alcanos un Hidrógeno (H) de su estructura, por lo que quedan con un par de electrones libres que los dispone para unirse a otros átomos de Carbono en una moléculas orgánica. Se les representa por la letra R (proviene del término Radicales) y se nombran colocando el sufijo il o ilo al Alcano correspondiente de donde se derivan. Los grupos R o Alquilos, se acompañan de unas Rayitas Horizontales ( R – ) que indican el par de electrones libres que está disponible para unirse en la cadena de Carbonos. (Los ejemplos están en el Texto).
Click aquí
APUNTES DE QUÍMICA ORGÁNICA
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 º
A- CLASIFICACIÓN DE LOS COMPUESTOS ORGÁNICOS
Definición de Hidrocarburos: Compuestos formados a base de Carbono e Hidrógeno en su estructura molecular , y es el esqueleto básico en la estructura molecular de los compuestos que forman las moléculas orgánicas.
Los Compuestos Orgánicos se clasifican en:
a) Hidrocarburos Alifáticos b) Hidrocarburos Aromáticos
Hidrocarburos Alifáticos
La palabra “Alifáticos ” proviene de "aliphos" que es de esta manera como se conocían las GRASAS que fueron el primer grupo de esta serie de compuestos que se estudió.
Los Hidrocarburos Alifáticos comprenden:
a) Hidrocarburos Saturados b) Hidrocarburos No Saturados
Hidrocarburos Saturados:
Son aquellos compuestos donde existe la máxima cantidad de enlaces covalentes simples entre átomos de Carbono. Los enlaces simples existentes son de tipo C– C. En estas moléculas tenemos la MAYOR cantidad de átomos de Hidrógeno que pueden unirse a los átomos de Carbono de la estructura de la molécula. En las moléculas con enlaces simples entre átomos de Carbono es donde existe MÁS cantidad de átomos de Hidrógeno presentes en la estructura.
Hidrocarburos NO Saturados:
Son aquellos compuestos donde NO existe la máxima cantidad de enlaces covalentes simples entre átomos de Carbono, ya que existen dobles y triples enlaces entre átomos de Carbono. Los enlaces existentes son de tipo
C C y C C. En estas moléculas tenemos la MENOR cantidad de átomos de Hidrógeno que pueden unirse a los átomos de Carbono, ya que cuando el Carbono se enlaza a otro átomo con enlaces dobles o triples, se va reduciendo la posibilidad de que se una con átomos de Hidrógeno. En las moléculas con enlaces triples entre átomos de Carbono es donde existe MENOS cantidad de átomos de Hidrógeno presentes en la estructura.
Por consiguiente, los Hidrocarburos Alifáticos contienen a los compuestos que según la cantidad de enlaces C – C se clasifican en Alcanos ( Enlaces simples ), Alquenos ( Enlaces dobles ) y Alquinos ( Enlaces triples ). (
Formulas Generales de los Hidrocarburos
* Alcanos : Cn H 2n + 2 * Alquenos: Cn H 2n * Alquinos: Cn H 2n – 2
Los Hidrocarburos alifáticos se dividen en:
- Hidrocarburos Lineales o de Cadena Abierta o Acíclicos
- Hidrocarburos Cíclicos , o de Cadena Cerrada o Alicíclicos
Estas dos divisiones de Hidrocarburos Alifáticos a su vez incluyen hidrocarburos Saturados y No Saturados.
Hidrocarburos Lineales: Son los de cadena lineal o en línea recta. Al escribir los nombres de estos compuestos se emplea la letra “n”. Ejemplos:
CH3 – CH2 – CH3 CH3 – CH2 – CH2 – CH3 CH3 – CH2 – CH2 – CH2 – CH2 – CH3
n – PROPANO n –BUTANO n –HEXANO
Los Hidrocarburos de Cadena abierta pueden tener ramificaciones u otras cadenas que se encuentran unidas a la estructura central. Se les llama: Hidrocarburos Ramificados.
CH3 – CH – CH2 – CH – CH2 – CH – CH2 – CH2 – CH2 – CH2 – CH3
CH3 (2º) CH2 (3º) CH – CH2 – CH2 – CH2 – CH2
CH3 CH – CH2 – CH3 CH3 (1º)
(4º)
CH3 – C – CH2 – CH3
CH3
Hidrocarburos Cíclicos: En estos hidrocarburos la cadena lineal se cierra para que se unan (enlacen) los átomos de Carbono que están EN LOS EXTREMOS de la cadena lineal. Al unirse los átomos de Carbono de los extremos de la
cadena se pierden átomos de Hidrógeno. Dependiendo del tipo de enlace formado (simple, doble, triple) con los Carbono extremos, se observa la pérdida de MÁS O MENOS átomos de Hidrógeno; dependiendo cuál sea el caso. Los Hidrocarburos Cíclicos adquieren formas geométricas que se pueden emplear al dibujar las estructuras.
CICLO PROPANO CICLO BUTANO CICLO HEXANO
CICLO PROPENO CICLO BUTENO CICLO HEXENO CICLO HEXINO
Los Hidrocarburos Cíclicos ya sean alcanos, alquenos o alquinos, poseen muy semejantes propiedades físicas y químicas que las del correspondiente hidrocarburo de cadena lineal.
Hidrocarburos Aromáticos
Hidrocarburos conformados por un compuesto característico llamado Benceno; el cual les confiere a estos Hidrocarburos un olor agradable (cerezas, duraznos y almendras) que nos ayuda a identificarlos fácilmente. El Benceno es un hidrocarburo de 6 carbonos y 6 hidrógenos (C6H6). Presenta estructura hexagonal con 3 dobles enlaces alternados. Estos dobles enlaces alternados NO ocupan una posición fija en el Benceno, por lo que constantemente los electrones de estos dobles enlaces (nube electrónica) están deslocalizados (se mueven o rotan a través de la estructura); esto conlleva a que la estructura del Benceno sea una estructura RESONANTE ( que no presentan una posición definida de sus electrones ).
Nota: El CÍRCULO en la última estructura ( letra C ) nos indica la Rotación Constante (Resonancia) de los electrones en los dobles enlaces de la Molécula de Benceno.
Los Compuestos Aromáticos se Dividen en:
a) Hidrocarburos Homocíclicos b) Hidrocarburos Heterocíclicos
- Hidrocarburos Aromáticos Homocíclicos: Son aquellos Hidrocarburos Aromáticos formados sólo por Carbono e Hidrógeno.
- Hidrocarburos Aromáticos Heterocíclicos: Estos hidrocarburos presentan Carbono, Hidrógeno y otros átomos que sustituyen al carbono dentro de la estructura, con la misma Tetravalencia o 4 enlaces del Carbono. Ejemplos: Si, Ge, Sn, Pb.
Los átomos de Carbono en las diferentes moléculas orgánicas, muchas veces deben ser clasificados según se encuentre unidos a UNO, DOS, TRES ó CUATRO átomos de Carbono. Según sea el caso los átomos de Carbono pueden ser :
a) Primarios: Unidos a UN solo átomo de Carbono. b) Secundarios: Unidos a DOS átomos de Carbono.
c) Terciarios : Unidos a TRES átomos de Carbono. d) Cuaternarios: Unidos a CUATRO átomos de Carbono.
Nota: Para referirnos a estos CUATRO tipos de átomos de Carbono observe la estructura de ejemplo ramificada presentada anteriormente y clasificada como: Hidrocarburos Ramificados. En ellas se resalta en negrita el Carbono y su clasificación según a cuántos otros átomos de Carbono están unidos ( Primarios 1º, Secundarios 2º,
Terciarios 3º, Cuaternarios 4º. )
Series Homólogas
Recibe este nombre una serie de compuestos orgánicos cuyos miembros difieren en una proporción constante de Carbono e Hidrógeno. En el caso de los Alcanos, Alquenos y Alquinos, estas familias forman tal serie homóloga, siendo la diferencia ( en el Orden Ascendente de la familia ) entre un compuesto y otro: Un Carbono y Dos Hidrógenos; es decir, un Grupo CH2.
ALCANOS (Cn H 2n + 2) ALQUENOS (Cn H 2n) ALQUINOS (Cn H 2n – 2)
C H 4
C 2 H 6 C 2 H 4 C 2 H 2
C 3 H 8 C 3 H 6 C 3 H 4
C 4 H 10 C 4 H 8 C 4 H 6
C 5 H 12 C 5 H 10 C 5 H 8
Grupos Alquilo o Radicales
Son grupos derivados de los Alcanos y que actúan como sustituyentes de las moléculas orgánicas convirtiéndolas en moléculas Ramificadas (Hidrocarburos Ramificados).
Estos grupos Alquilos, Sustituyentes o Radicales se obtienen al retirarles a los compuestos Alcanos un Hidrógeno (H) de su estructura, por lo que quedan con un par de electrones libres que los dispone para unirse a otros átomos de Carbono en una moléculas orgánica. Se les representa por la letra R (proviene del término Radicales) y se nombran colocando el sufijo il o ilo al Alcano correspondiente de donde se derivan. Los grupos R o Alquilos, se acompañan de unas Rayitas Horizontales ( R – ) que indican el par de electrones libres que está disponible para unirse en la cadena de Carbonos. (Los ejemplos están en el Texto).
viernes, 21 de mayo de 2010
martes, 11 de mayo de 2010
Práctica de PPM, FM. %Molar
COLEGIO DE LA SALLE
PRÁCTICA DE QUÍMICA 12° TEMA: PPM, FMOLAR, % MOLAR
PARTES POR MILLÓN
Una solución acuosa diluida del ión Cloruro tiene una concentración de 10.25 PPM. ¿ Cuántos mL de la
solución se requieren para obtener 8.75 X10 – 3 g del ión Cloruro?. R: 853.66 mL
2- Calcule los mg. de ión Nitrato en 2.75 L de una solución acuosa diluida que tiene 20.00 PPM del ión presente.
R: 55 mg
Determine los Kg de una solución acuosa diluida que contienen 500 mg de iones Sodio si la solución tiene una
concentración de 100 PPM . R: 5.00 Kg
4- Determine los μg del ión Calcio que están presentes en 3.25 dm3 de una Solución acuosa diluida que
contiene 450 PPM del ión metálico. R: 1.46 X 10 6 μg
5- Una solución acuosa diluida tiene una concentración de 100 PPM del ión Sulfato. Basados en estos datos
determinar: a) ¿ Cuál es la pureza de Sulfato en la solución ? b) ¿Cuál es el % m / v del ión en la solución ?
c) ¿ Cuántos mg del ión estarán presentes en medio litro de la solución ?
R: a) 1.00 X 10 – 2 % m / m b) 1.00 X 10 – 2 % m / v c) 50 mg
6- Calcule las PPM de soluto en cada una de las siguientes soluciones acuosas diluidas:
a) 200 mg del ión Magnesio en medio litro de una muestra de agua
b) 340 mg del ión Hierro en 2000 mL de una muestra de agua c) 3.50 mg del ión Cloruro en 4.25 L de agua de
mar R: a) 399.84 PPM b) 169.97 PPM c) 8.24 X 10 – 1 PPM
La concentración máxima de un metal desconocido que se permite en el agua potable es de 2.75 X 10 - 1 PPM.
Exprese esta concentración en unidades : a) mg soluto / L solución b) mg soluto / Kg solución
R: a) 2.75 X 10 - 1 mg / L b) 2.75 X 10 - 1 mg / Kg
8- Evalúe los mg de soluto disueltos en las siguientes soluciones acuosas diluidas:
a) 10.75 L de una muestra de agua que tiene 35 PPM del ión Plumboso
b) 1.50 X10 4 mL de agua del océano que tiene una concentración de 285 PPM del ión Clorito
c) 30.0 L de agua del océano que tiene 8.00 X 10 - 3 PPM del ión Cúprico
R: a) 376.25 mg b) 4.28 X 10 3 mg c) 2.40 X 10 – 1 mg
9- Si una solución acuosa diluida presenta una concentración de 6.00 X 10 – 2 % m / m del ión Hipoyodito;
determine: a) La concentración PPM del ión Hipoyodito en la solución b) El % m / v del ión en la
solución c) Los gramos del ión en medio litro de la solución.
R: a) 600 PPM b) 6.00 X 10 – 2 % m / v c) 3.00 X 10 2 g
10- Una solución acuosa diluida presenta una concentración de 5.60 X 10 – 4 % m / m del ión Oxalato. Basados
en los criterios de concentración PPM, determine:
a) Los gramos del ión presentes en 1L de la solución b) El % m / v del ión en la solución
c) La concentración PPM del ión en la solución.
R: a) 5.60 X 10 – 3 g b) ???? X 10 – n % m / v c) ???? ppm
FRACCIÓN MOLAR y PORCENTAJE MOLAR
11- Se disuelven 25 g de Metanol (CH3OH) en 50 g de agua. Calcular : a) La fracción molar del metanol
b) La fracción molar del agua en la solución
R: a) 0.22 Metanol b) 0.78 H2O
12- Determinar respectivamente las fracciones molares de soluto y solvente en una disolución que contiene
15 g de Glicerina (C3 H8 O3) disueltos en 250 cm3 de Benceno (C6H6) de densidad 0.88 g / ml.
R: 0.05 Soluto ; 0.95 Solvente
13- Una solución acuosa de Ácido sulfúrico cuya concentración es 22.80 % m/v, tiene una densidad de 1.14 g /ml.
Calcular para la solución: a) La fracción molar de agua en la disolución b) La fracción molar del Ácido .
R: a) 9.56 X 10 -1 b) 4.40 X 10 – 2
14- Una solución acuosa de Cromato de potasio tiene una densidad de 1.35 g / ml y es 30 % m/m. Calcular para
la solución:
a) La fracción molar del soluto b) La fracción molar del solvente en la solución .
R: a) 0.04 b) 0.96
15- Una solución acuosa diluida presenta una concentración de ión Fosfato de 520 PPM.. Determine para esta
solución: a) La fracción molar del solvente en la disolución b) El % m/v c) El % m/m
R: a) 0.99 b) 5.20 X 10 – 2 % m/v c) 5.20 X 10 – 2 % m/m
16- ¿ Cuántos gramos de Nitrato de calcio deben añadirse a 340 cm3 de agua para obtener una disolución
cuya fracción molar de solvente sea 0.98 ? R: 63.22 g
17- Se disuelven 75 cm3 de Alcohol etílico (C2 H 5 OH) de densidad 0.78 g / ml en 500 cm3 de Benceno
(C 6 H 6) de densidad 0.88 g /cm3 . Con esta información determine para la solución resultante :
a) Fracción molar de soluto b) Fracción molar de solvente .
R: a ) 0.184 b) 0. 816
18- Si una solución contiene 4 moles de Etanol (C2 H 5OH) y 12 moles de agua , calcule respectivamente
las fracciones molares del alcohol y agua en esta solución. b) Determine en el mismo orden el
porcentaje molar de cada componente.
R: a) 0.25 Alcohol ; 0.75 Agua b) 25 % Alcohol ; 75% Agua
19- Calcular la FM de soluto y de solvente en una disolución Alcohólica (C2H5OH )de Naftaleno (C1 0H 8)
preparada al 30 % m / v y cuya densidad de solución sea de 0.92 g /mL.
R: FM soluto: 0.145 ; FM solvente 0.854
20- ¿ Cuál es el % molar de Urea (CON2H4) en una solución acuosa que tiene una concentración del 10 % m/m de
Urea ? R: 3.29 %
21- ¿ Cuáles son respectivamente el % molar de Fenol (C6H5OH) y Alcohol etílico (C2 H 5OH) en una
solución alcohólica que contiene 23.50 g de Fenol y 41.40 g del alcohol ?.
R: 21.74 % Fenol ; 78.26 % Alcohol
22- En una solución acuosa de Cloruro de sodio, la fracción molar de la sal binaria es 0.10. Con esta información
determine para la solución a) El % m/m de la sal b) El % molar de la sal binaria.
R: a) ¿??? % m/m b) ¿???? % molar
23- Al mezclar 60.0 g de un compuesto A de Peso molecular 18.02 g / mol , con X cantidad en gramos de
Etanol (C2 H 5OH) de densidad 0.80 g /ml, se obtienen 110 cm3 de una solución con una densidad de
0.909 g /ml. Basados en esta información evaluar para la solución: a) El % m/m del alcohol b) El % m/v
del alcohol c) El % v/v del alcohol d) El % molar del alcohol d) La fracción molar del compuesto A .
R: a) 40 % m/m b) 36.36 % m/v c) 45.45 % v/v d) 20.53 % e) 0.79
24- Si el % molar de Hidróxido de sodio en una solución acuosa es de 29.50 % molar , calcular:
a) La fracción molar del solvente en la solución b) El volumen en litros del solvente presente.
R: a) 0.705 b) 1.27 litros
25- Si el % molar del solvente en una solución acuosa de Fluoruro de sodio es de 75.20 % y la densidad de la
solución es de 1.55 g /ml. Calcular con estos datos:
a) La fracción molar de la sal en la solución b) La masa en gramos de la sal presente c) El % m/m
d) EL % m/v de la solución
R: a) 2.48 X 10 -1 b) 1.042 X 10 3 g c) 43.49 % P/P d) 67.40 % P/V
Calcular el Porcentaje Molar de soluto y solvente en una disolución acuosa de Sulfato de magnesio preparada
al 25 % m / v y que tiene una densidad de solución de 1.22 g / cm 3.
R: % Molar soluto = 3.74 % ; % Molar solvente = 96.27 %
¿Qué volumen en cm3 de Benceno (solvente) (C 6 H 6 ) cuya densidad es 0.88 g /mL debe añadirse a 96 g de
Naftaleno (soluto) (C10 H8 ) para obtener una disolución cuya FM de soluto sea 0.06 ?. R: 1041.47 cm3
¿Cuántos gramos de Agua hay que añadir a 205g de Fosfato de sodio para obtener una disolución cuya FM de
solvente sea 0.90 ?. R: 202.5 g
¿Cuántos gramos de Cloruro de calcio deben disolverse en 720 cm3 de Agua para obtener una disolución cuya
FM de soluto sea 1.40 X10 – 2 ?. R: 63.27g
30-¿ Cuántos mL de Agua hay que añadir a 8.40 g de Hidróxido de potasio para obtener una disolución cuya FM de
agua sea de 0.975 ?. b) ¿ Cuál es el % m / m de la disolución ?. R: a) 105.3 mL ; b) 7.39 % m / m
PRÁCTICA DE QUÍMICA 12° TEMA: PPM, FMOLAR, % MOLAR
PARTES POR MILLÓN
Una solución acuosa diluida del ión Cloruro tiene una concentración de 10.25 PPM. ¿ Cuántos mL de la
solución se requieren para obtener 8.75 X10 – 3 g del ión Cloruro?. R: 853.66 mL
2- Calcule los mg. de ión Nitrato en 2.75 L de una solución acuosa diluida que tiene 20.00 PPM del ión presente.
R: 55 mg
Determine los Kg de una solución acuosa diluida que contienen 500 mg de iones Sodio si la solución tiene una
concentración de 100 PPM . R: 5.00 Kg
4- Determine los μg del ión Calcio que están presentes en 3.25 dm3 de una Solución acuosa diluida que
contiene 450 PPM del ión metálico. R: 1.46 X 10 6 μg
5- Una solución acuosa diluida tiene una concentración de 100 PPM del ión Sulfato. Basados en estos datos
determinar: a) ¿ Cuál es la pureza de Sulfato en la solución ? b) ¿Cuál es el % m / v del ión en la solución ?
c) ¿ Cuántos mg del ión estarán presentes en medio litro de la solución ?
R: a) 1.00 X 10 – 2 % m / m b) 1.00 X 10 – 2 % m / v c) 50 mg
6- Calcule las PPM de soluto en cada una de las siguientes soluciones acuosas diluidas:
a) 200 mg del ión Magnesio en medio litro de una muestra de agua
b) 340 mg del ión Hierro en 2000 mL de una muestra de agua c) 3.50 mg del ión Cloruro en 4.25 L de agua de
mar R: a) 399.84 PPM b) 169.97 PPM c) 8.24 X 10 – 1 PPM
La concentración máxima de un metal desconocido que se permite en el agua potable es de 2.75 X 10 - 1 PPM.
Exprese esta concentración en unidades : a) mg soluto / L solución b) mg soluto / Kg solución
R: a) 2.75 X 10 - 1 mg / L b) 2.75 X 10 - 1 mg / Kg
8- Evalúe los mg de soluto disueltos en las siguientes soluciones acuosas diluidas:
a) 10.75 L de una muestra de agua que tiene 35 PPM del ión Plumboso
b) 1.50 X10 4 mL de agua del océano que tiene una concentración de 285 PPM del ión Clorito
c) 30.0 L de agua del océano que tiene 8.00 X 10 - 3 PPM del ión Cúprico
R: a) 376.25 mg b) 4.28 X 10 3 mg c) 2.40 X 10 – 1 mg
9- Si una solución acuosa diluida presenta una concentración de 6.00 X 10 – 2 % m / m del ión Hipoyodito;
determine: a) La concentración PPM del ión Hipoyodito en la solución b) El % m / v del ión en la
solución c) Los gramos del ión en medio litro de la solución.
R: a) 600 PPM b) 6.00 X 10 – 2 % m / v c) 3.00 X 10 2 g
10- Una solución acuosa diluida presenta una concentración de 5.60 X 10 – 4 % m / m del ión Oxalato. Basados
en los criterios de concentración PPM, determine:
a) Los gramos del ión presentes en 1L de la solución b) El % m / v del ión en la solución
c) La concentración PPM del ión en la solución.
R: a) 5.60 X 10 – 3 g b) ???? X 10 – n % m / v c) ???? ppm
FRACCIÓN MOLAR y PORCENTAJE MOLAR
11- Se disuelven 25 g de Metanol (CH3OH) en 50 g de agua. Calcular : a) La fracción molar del metanol
b) La fracción molar del agua en la solución
R: a) 0.22 Metanol b) 0.78 H2O
12- Determinar respectivamente las fracciones molares de soluto y solvente en una disolución que contiene
15 g de Glicerina (C3 H8 O3) disueltos en 250 cm3 de Benceno (C6H6) de densidad 0.88 g / ml.
R: 0.05 Soluto ; 0.95 Solvente
13- Una solución acuosa de Ácido sulfúrico cuya concentración es 22.80 % m/v, tiene una densidad de 1.14 g /ml.
Calcular para la solución: a) La fracción molar de agua en la disolución b) La fracción molar del Ácido .
R: a) 9.56 X 10 -1 b) 4.40 X 10 – 2
14- Una solución acuosa de Cromato de potasio tiene una densidad de 1.35 g / ml y es 30 % m/m. Calcular para
la solución:
a) La fracción molar del soluto b) La fracción molar del solvente en la solución .
R: a) 0.04 b) 0.96
15- Una solución acuosa diluida presenta una concentración de ión Fosfato de 520 PPM.. Determine para esta
solución: a) La fracción molar del solvente en la disolución b) El % m/v c) El % m/m
R: a) 0.99 b) 5.20 X 10 – 2 % m/v c) 5.20 X 10 – 2 % m/m
16- ¿ Cuántos gramos de Nitrato de calcio deben añadirse a 340 cm3 de agua para obtener una disolución
cuya fracción molar de solvente sea 0.98 ? R: 63.22 g
17- Se disuelven 75 cm3 de Alcohol etílico (C2 H 5 OH) de densidad 0.78 g / ml en 500 cm3 de Benceno
(C 6 H 6) de densidad 0.88 g /cm3 . Con esta información determine para la solución resultante :
a) Fracción molar de soluto b) Fracción molar de solvente .
R: a ) 0.184 b) 0. 816
18- Si una solución contiene 4 moles de Etanol (C2 H 5OH) y 12 moles de agua , calcule respectivamente
las fracciones molares del alcohol y agua en esta solución. b) Determine en el mismo orden el
porcentaje molar de cada componente.
R: a) 0.25 Alcohol ; 0.75 Agua b) 25 % Alcohol ; 75% Agua
19- Calcular la FM de soluto y de solvente en una disolución Alcohólica (C2H5OH )de Naftaleno (C1 0H 8)
preparada al 30 % m / v y cuya densidad de solución sea de 0.92 g /mL.
R: FM soluto: 0.145 ; FM solvente 0.854
20- ¿ Cuál es el % molar de Urea (CON2H4) en una solución acuosa que tiene una concentración del 10 % m/m de
Urea ? R: 3.29 %
21- ¿ Cuáles son respectivamente el % molar de Fenol (C6H5OH) y Alcohol etílico (C2 H 5OH) en una
solución alcohólica que contiene 23.50 g de Fenol y 41.40 g del alcohol ?.
R: 21.74 % Fenol ; 78.26 % Alcohol
22- En una solución acuosa de Cloruro de sodio, la fracción molar de la sal binaria es 0.10. Con esta información
determine para la solución a) El % m/m de la sal b) El % molar de la sal binaria.
R: a) ¿??? % m/m b) ¿???? % molar
23- Al mezclar 60.0 g de un compuesto A de Peso molecular 18.02 g / mol , con X cantidad en gramos de
Etanol (C2 H 5OH) de densidad 0.80 g /ml, se obtienen 110 cm3 de una solución con una densidad de
0.909 g /ml. Basados en esta información evaluar para la solución: a) El % m/m del alcohol b) El % m/v
del alcohol c) El % v/v del alcohol d) El % molar del alcohol d) La fracción molar del compuesto A .
R: a) 40 % m/m b) 36.36 % m/v c) 45.45 % v/v d) 20.53 % e) 0.79
24- Si el % molar de Hidróxido de sodio en una solución acuosa es de 29.50 % molar , calcular:
a) La fracción molar del solvente en la solución b) El volumen en litros del solvente presente.
R: a) 0.705 b) 1.27 litros
25- Si el % molar del solvente en una solución acuosa de Fluoruro de sodio es de 75.20 % y la densidad de la
solución es de 1.55 g /ml. Calcular con estos datos:
a) La fracción molar de la sal en la solución b) La masa en gramos de la sal presente c) El % m/m
d) EL % m/v de la solución
R: a) 2.48 X 10 -1 b) 1.042 X 10 3 g c) 43.49 % P/P d) 67.40 % P/V
Calcular el Porcentaje Molar de soluto y solvente en una disolución acuosa de Sulfato de magnesio preparada
al 25 % m / v y que tiene una densidad de solución de 1.22 g / cm 3.
R: % Molar soluto = 3.74 % ; % Molar solvente = 96.27 %
¿Qué volumen en cm3 de Benceno (solvente) (C 6 H 6 ) cuya densidad es 0.88 g /mL debe añadirse a 96 g de
Naftaleno (soluto) (C10 H8 ) para obtener una disolución cuya FM de soluto sea 0.06 ?. R: 1041.47 cm3
¿Cuántos gramos de Agua hay que añadir a 205g de Fosfato de sodio para obtener una disolución cuya FM de
solvente sea 0.90 ?. R: 202.5 g
¿Cuántos gramos de Cloruro de calcio deben disolverse en 720 cm3 de Agua para obtener una disolución cuya
FM de soluto sea 1.40 X10 – 2 ?. R: 63.27g
30-¿ Cuántos mL de Agua hay que añadir a 8.40 g de Hidróxido de potasio para obtener una disolución cuya FM de
agua sea de 0.975 ?. b) ¿ Cuál es el % m / m de la disolución ?. R: a) 105.3 mL ; b) 7.39 % m / m
lunes, 19 de abril de 2010
APUNTES DE QUÍMICA ORGÁNICA
Para descargar el documento completo
Click Aquí
APUNTES DE QUÍMICA ORGÁNICA
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 º
A- DEFINICIÓN ANTIGUA
La Química Orgánica está basada en el estudio de compuestos a base de Carbono, tomando en cuenta que estos provienen de la materia viviente.
La Química Orgánica en un principio se apoyó en la Teoría o Síntesis Vitalista ( Fuerza Vital ) que sustentaba que TODOS los Compuestos orgánicos provienen de material viviente o que tienen una fuerza vital. Esta teoría fue eliminada cuando Fredrich Wöhler sintetiza un compuesto Orgánico a partir de un compuesto Inorgánico. Específicamente sintetiza la Urea orgánica ( ( NH2 )2 CO ) a partir del compuesto inorgánico Cianato de amonio. Esto conlleva a que se cambie el concepto de Química Orgánica ya que los Compuestos Orgánicos NO son necesariamente los que provienen de organismos vivos.
La Urea, es una sustancia nitrogenada producida por algunos seres vivos como medio de eliminación del amoníaco, el cuál es altamente tóxico para ellos. En los animales se halla en la sangre, orina, bilis y sudor.
La urea es un sólido cristalino y blanco de forma esférica o granular. Es una sustancia soluble en agua y presenta un ligero olor a amoníaco.
La urea es el resultado final del metabolismo de las proteínas en el organismo de los animales. Se forma en el hígado a partir de la destrucción de las proteínas. Durante la digestión, las proteínas son separadas en aminoácidos, estos contiene nitrógeno que se libera como ión amonio, y el resto de la molécula se utiliza para generar energía en las células y tejidos. El amonio se une a pequeñas moléculas para producir urea, la cual aparece en la sangre y es eliminada por la orina.
B- CARACTERÍSTICAS PRINCIPALES DEL CARBONO
El Carbono es el constituyente principal para la vida. Forma parte de compuestos presentes en animales y vegetales. Forma por el proceso de Concatenación largas cadenas de C–C y esta es una característica que NO presentan todos los elementos de la Tabla Períodica; aunque una excepción es el Silicio (Si), el cual es un elemento Inorgánico que forma cadenas pero más cortas, como por ejemplo las cadenas de Silicona ( para los implantes ).
Esta habilidad del Carbono de formar cadenas de Carbono, es la responsable de la infinidad de Compuestos Orgánicos existentes en el orden de los millones aunque se siguen descubriendo otros más.
El Carbono presenta gran afinidad por los siguientes elementos: el Oxígeno (O2 ), el Hidrógeno (H2), el Azufre (S), Nitrógeno (N2 ) y los Halógenos (VII A) con los cuales forma enlaces Covalentes.
La característica de Concatenación le permite al Carbono formar loscompuestos conocidos como Biomoléculas y Polimeros (o plásticos). Las biomoléculas son grandes moléculas que hacen posible la preservación y reproducción de la vida (Carbohidratos, lípidos y proteínas ). Los polímeros son compuestos sintéticos formados por largas cadenas de Carbono constituidas por moléculas pequeñas o unidades estructurales llamadas monómeros.
En los hogares el Carbono se utiliza en forma de CCarbón vegetal, que es el producto de la calcinación de materia vegetal.
C- GENERALIDADES QUÍMICAS DEL CARBONO
El carbono forma parte del reino orgánico pero también está presente en el reino mineral en forma de Carbonatos, Bicarbonatos, Sulfuro de Carbono, Carburos, Cianuros ( tóxico ) y en la atmósfera en forma de óxidos de Carbono (CO ( tóxico ) y CO2 )
El ión Cianuro (CN) 1 – es potencialmente letal, actuando como tóxico a través de la inhibición del Proceso de respiración celular. Por consecuencia, causa una baja en el tan necesario Oxígeno intracelular.
El principal efecto nocivo y letal de las diversas variedades de Cianuro es el impedir que el oxígeno portado por los glóbulos rojos llegue a las demás células del organismo, impidiendo así el proceso de la respiración celular.
El CO como contaminante se une a la Hb (Hemoglobina) que es la proteína responsable de transportar el O2 de los pulmones a los diferentes tejidos del cuerpo. Al unirse el CO a la Hb en vez de O2, se produce un compuesto llamado Carboxihemoglobina; cuando es el O2 quien va unido a la Hb el compuesto formado recibe el nombre de oxihemoglobina. La Hb tiene la peculiaridad que forma compuestos más estables con el CO que con el O2 , por lo que es bien afín el CO con la Hb (200 veces más afín el CO por la Hb que el O2 ). Siendo el CO un gas tóxico, incoloro e inodoro cuya presencia se determina por los siguientes síntomas: dificultades respiratorias o asfixias, somnolencia, fatiga, mareo, dolor de cabeza y muerte.
D- FORMAS PURAS DEL CARBONO
En el estado libre puro el Carbono cristaliza en dos formas; estas son:
Diamente : Es una variedad pura de Carbono. Cristaliza en forma de Tetraedro regular ( pirámide ) y es una sustancia o material de gran dureza por los enlaces C–C bastante fuertes. (BUSCAR FIGURA EN INTERNET)
Grafito: Forma pura de Carbono. El grafito se utiliza en las minas de lápices y como electrodo ( Terminal de conducción eléctrica ) en pilas secas. Es un buen conductor de electricidad ya que posee enlaces débiles. Es de color negro con textura blanda . Cristaliza en forma de placas hexagonales dispuestas en láminas horizontales colocadas una sobre otra. (BUSCAR FIGURA EN INTERNET).
E- FORMAS NO PURAS DEL CARBONO
Carbón Vegetal : Es una de las formas de Carbono artificial más utilizada. Es el producto de la pirólisis, craqueo o destilación seca de la madera (material vegetal). Se emplea como combustible para calderas, trenes,
BBQ ( barbacoas).
F- CONFIGURACIÓN ELECTRÓNICA DEL CARBONO
El número atómico ( Z ) del Carbono es Z = 6. La configuración electrónica para el átomo de Carbono es:
1 S 2 2 S 2 2 P 2. Según esta configuración el átomo de Carbono sólo tiene capacidad para formar TRES enlaces Covalente (por compartimiento de los electrones del orbital “ P ”) en TOTAL. Dos enlaces covalentes simples se formarán con los Orbitales “P” que tienen electrones; y UN enlace Covalente coordinado con el orbital “P ” vacío que NO aporta electrones para enlaces y sólo recibe el par de electrones del otro átomo con el que forme el enlace covalente.
En conclusión , con esta configuración sólo se pueden lograr TRES enlaces , pero sabemos que cada átomo de Carbono tiene capacidad para formar CUATRO enlaces. ¿ Cómo logra convertirse de un átomo con capacidad para tres enlaces a un átomo con capacidad para cuatro enlaces ?
Con la configuración electrónica NORMAL, el Carbono presenta una máxima repulsión por el efecto de los electrones apiñados y se considera una especie inestable.
Los átomos de Carbono en la búsqueda de una mayor estabilidad , promueven UN electrón del orbital “S” a UN orbital tipo “P”, logrando que el Carbono tenga una máxima capacidad para 4 enlaces. A esta promoción de electrones de un orbital a otro se le conoce como Hibridación.
HIBRIDACIÓN:
Son los orbitales que se obtienen como resultado de la mezcla o combinación de los orbitales atómicos NO Equivalentes (de diferentes letras S,P,d,f -Suniveles) del mismo átomo, con el propósito de preparar al átomo para la formación del enlace covalente. En el Carbono se combinan orbitales “S” y “P” para darle la máxima capacidad de enlace al átomo.
G- FÓRMULAS QUÍMICAS EMPLEADAS EN LA QUÍMICA ORGÁNICA
FÓRMULA ESTRUCTURAL:
Representación de la molécula orgánica usando líneas que dan información sobre el número y clase de enlaces.
METANO ETANO
FÓRMULA MOLECULAR:
Representación de la molécula mediante la proporción exacta en que se encuentran los átomos que la conforman. NO
Presenta ningún tipo de enlaces.
CH4 C3 H8 C5 H12 C10 H8
METANO PROPANO PENTANO NAFTALENO
FÓRMULA SIMPLIFICADA:
Son las fórmulas que se emplean mayormente en la representación de las moléculas orgánicas. No se detallan los enlaces C–H; pero SÍ los enlaces C–C.
CH3 – CH2 – CH2 – CH3 BUTANO CH3 – CH – CH3 METILPROPANO
BUTANO
CH3
FÓRMULA CONDENSADA:
Es aquella representación que se emplea para abreviar largas cadenas que contienen unidades que se repiten subsecuentemente.
Ejemplo: CH3 –CH2 –CH2 – CH2 –CH2 – CH2 –CH2 – CH2 –CH2 – CH3 FÓRMULA SIMPLIFICADA
CH3 – (CH2) 8 –CH3 FÓRMULA CONDENSADA
GEOMETRÍA MOLECULAR:
Es la distribución tridimensional de los átomos de una molécula. Indica la orientación espacial de los átomos que forman la molécula. Así obtenemos diversas formas: Lineales, Tetraédricas, Octaédricas, Angular, Trigonal, Piramidal, Hexagonal, etc. (BUSCAR FIGURAS EN INTERNET)
H- CARACTERÍSTICAS DE LOS COMPUESTOS ORGÁNICOS E INORGÁNICOS
I- ISÓMEROS
Son compuestos DIFERENTES que poseen la misma fórmula molecular (proporciones) pero difieren de su fórmula estructural o simplificada. Como a pesar de tener la misma proporción de átomos constituyentes se trata de compuestos diferentes, éstos entre ellos tienen propiedades químicas y físicas distintas.
Un ejemplo de isómeros son: El Alcohol Etílico (Etanol) y el Éter dimetílico. Ambos corresponden a la fórmula molecular C2 H6O pero se trata de compuestos con propiedades totalmente diferentes entre sí.
CH3 - CH2 – OH: Corresponde al Etanol; que es un líquido que hierve a 78 °C.
CH3 - O - CH3 corresponde al Éter dimetílico; que es un gas que tiene punto de ebullición de 24 °C.
CH3 – CH2 – CH2 – CH3 BUTANO CH3 – CH – CH3 METILPROPANO
BUTANO
CH3
Click Aquí
APUNTES DE QUÍMICA ORGÁNICA
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 º
A- DEFINICIÓN ANTIGUA
La Química Orgánica está basada en el estudio de compuestos a base de Carbono, tomando en cuenta que estos provienen de la materia viviente.
La Química Orgánica en un principio se apoyó en la Teoría o Síntesis Vitalista ( Fuerza Vital ) que sustentaba que TODOS los Compuestos orgánicos provienen de material viviente o que tienen una fuerza vital. Esta teoría fue eliminada cuando Fredrich Wöhler sintetiza un compuesto Orgánico a partir de un compuesto Inorgánico. Específicamente sintetiza la Urea orgánica ( ( NH2 )2 CO ) a partir del compuesto inorgánico Cianato de amonio. Esto conlleva a que se cambie el concepto de Química Orgánica ya que los Compuestos Orgánicos NO son necesariamente los que provienen de organismos vivos.
La Urea, es una sustancia nitrogenada producida por algunos seres vivos como medio de eliminación del amoníaco, el cuál es altamente tóxico para ellos. En los animales se halla en la sangre, orina, bilis y sudor.
La urea es un sólido cristalino y blanco de forma esférica o granular. Es una sustancia soluble en agua y presenta un ligero olor a amoníaco.
La urea es el resultado final del metabolismo de las proteínas en el organismo de los animales. Se forma en el hígado a partir de la destrucción de las proteínas. Durante la digestión, las proteínas son separadas en aminoácidos, estos contiene nitrógeno que se libera como ión amonio, y el resto de la molécula se utiliza para generar energía en las células y tejidos. El amonio se une a pequeñas moléculas para producir urea, la cual aparece en la sangre y es eliminada por la orina.
B- CARACTERÍSTICAS PRINCIPALES DEL CARBONO
El Carbono es el constituyente principal para la vida. Forma parte de compuestos presentes en animales y vegetales. Forma por el proceso de Concatenación largas cadenas de C–C y esta es una característica que NO presentan todos los elementos de la Tabla Períodica; aunque una excepción es el Silicio (Si), el cual es un elemento Inorgánico que forma cadenas pero más cortas, como por ejemplo las cadenas de Silicona ( para los implantes ).
Esta habilidad del Carbono de formar cadenas de Carbono, es la responsable de la infinidad de Compuestos Orgánicos existentes en el orden de los millones aunque se siguen descubriendo otros más.
El Carbono presenta gran afinidad por los siguientes elementos: el Oxígeno (O2 ), el Hidrógeno (H2), el Azufre (S), Nitrógeno (N2 ) y los Halógenos (VII A) con los cuales forma enlaces Covalentes.
La característica de Concatenación le permite al Carbono formar loscompuestos conocidos como Biomoléculas y Polimeros (o plásticos). Las biomoléculas son grandes moléculas que hacen posible la preservación y reproducción de la vida (Carbohidratos, lípidos y proteínas ). Los polímeros son compuestos sintéticos formados por largas cadenas de Carbono constituidas por moléculas pequeñas o unidades estructurales llamadas monómeros.
En los hogares el Carbono se utiliza en forma de CCarbón vegetal, que es el producto de la calcinación de materia vegetal.
C- GENERALIDADES QUÍMICAS DEL CARBONO
El carbono forma parte del reino orgánico pero también está presente en el reino mineral en forma de Carbonatos, Bicarbonatos, Sulfuro de Carbono, Carburos, Cianuros ( tóxico ) y en la atmósfera en forma de óxidos de Carbono (CO ( tóxico ) y CO2 )
El ión Cianuro (CN) 1 – es potencialmente letal, actuando como tóxico a través de la inhibición del Proceso de respiración celular. Por consecuencia, causa una baja en el tan necesario Oxígeno intracelular.
El principal efecto nocivo y letal de las diversas variedades de Cianuro es el impedir que el oxígeno portado por los glóbulos rojos llegue a las demás células del organismo, impidiendo así el proceso de la respiración celular.
El CO como contaminante se une a la Hb (Hemoglobina) que es la proteína responsable de transportar el O2 de los pulmones a los diferentes tejidos del cuerpo. Al unirse el CO a la Hb en vez de O2, se produce un compuesto llamado Carboxihemoglobina; cuando es el O2 quien va unido a la Hb el compuesto formado recibe el nombre de oxihemoglobina. La Hb tiene la peculiaridad que forma compuestos más estables con el CO que con el O2 , por lo que es bien afín el CO con la Hb (200 veces más afín el CO por la Hb que el O2 ). Siendo el CO un gas tóxico, incoloro e inodoro cuya presencia se determina por los siguientes síntomas: dificultades respiratorias o asfixias, somnolencia, fatiga, mareo, dolor de cabeza y muerte.
D- FORMAS PURAS DEL CARBONO
En el estado libre puro el Carbono cristaliza en dos formas; estas son:
Diamente : Es una variedad pura de Carbono. Cristaliza en forma de Tetraedro regular ( pirámide ) y es una sustancia o material de gran dureza por los enlaces C–C bastante fuertes. (BUSCAR FIGURA EN INTERNET)
Grafito: Forma pura de Carbono. El grafito se utiliza en las minas de lápices y como electrodo ( Terminal de conducción eléctrica ) en pilas secas. Es un buen conductor de electricidad ya que posee enlaces débiles. Es de color negro con textura blanda . Cristaliza en forma de placas hexagonales dispuestas en láminas horizontales colocadas una sobre otra. (BUSCAR FIGURA EN INTERNET).
E- FORMAS NO PURAS DEL CARBONO
Carbón Vegetal : Es una de las formas de Carbono artificial más utilizada. Es el producto de la pirólisis, craqueo o destilación seca de la madera (material vegetal). Se emplea como combustible para calderas, trenes,
BBQ ( barbacoas).
F- CONFIGURACIÓN ELECTRÓNICA DEL CARBONO
El número atómico ( Z ) del Carbono es Z = 6. La configuración electrónica para el átomo de Carbono es:
1 S 2 2 S 2 2 P 2. Según esta configuración el átomo de Carbono sólo tiene capacidad para formar TRES enlaces Covalente (por compartimiento de los electrones del orbital “ P ”) en TOTAL. Dos enlaces covalentes simples se formarán con los Orbitales “P” que tienen electrones; y UN enlace Covalente coordinado con el orbital “P ” vacío que NO aporta electrones para enlaces y sólo recibe el par de electrones del otro átomo con el que forme el enlace covalente.
En conclusión , con esta configuración sólo se pueden lograr TRES enlaces , pero sabemos que cada átomo de Carbono tiene capacidad para formar CUATRO enlaces. ¿ Cómo logra convertirse de un átomo con capacidad para tres enlaces a un átomo con capacidad para cuatro enlaces ?
Con la configuración electrónica NORMAL, el Carbono presenta una máxima repulsión por el efecto de los electrones apiñados y se considera una especie inestable.
Los átomos de Carbono en la búsqueda de una mayor estabilidad , promueven UN electrón del orbital “S” a UN orbital tipo “P”, logrando que el Carbono tenga una máxima capacidad para 4 enlaces. A esta promoción de electrones de un orbital a otro se le conoce como Hibridación.
HIBRIDACIÓN:
Son los orbitales que se obtienen como resultado de la mezcla o combinación de los orbitales atómicos NO Equivalentes (de diferentes letras S,P,d,f -Suniveles) del mismo átomo, con el propósito de preparar al átomo para la formación del enlace covalente. En el Carbono se combinan orbitales “S” y “P” para darle la máxima capacidad de enlace al átomo.
G- FÓRMULAS QUÍMICAS EMPLEADAS EN LA QUÍMICA ORGÁNICA
FÓRMULA ESTRUCTURAL:
Representación de la molécula orgánica usando líneas que dan información sobre el número y clase de enlaces.
METANO ETANO
FÓRMULA MOLECULAR:
Representación de la molécula mediante la proporción exacta en que se encuentran los átomos que la conforman. NO
Presenta ningún tipo de enlaces.
CH4 C3 H8 C5 H12 C10 H8
METANO PROPANO PENTANO NAFTALENO
FÓRMULA SIMPLIFICADA:
Son las fórmulas que se emplean mayormente en la representación de las moléculas orgánicas. No se detallan los enlaces C–H; pero SÍ los enlaces C–C.
CH3 – CH2 – CH2 – CH3 BUTANO CH3 – CH – CH3 METILPROPANO
BUTANO
CH3
FÓRMULA CONDENSADA:
Es aquella representación que se emplea para abreviar largas cadenas que contienen unidades que se repiten subsecuentemente.
Ejemplo: CH3 –CH2 –CH2 – CH2 –CH2 – CH2 –CH2 – CH2 –CH2 – CH3 FÓRMULA SIMPLIFICADA
CH3 – (CH2) 8 –CH3 FÓRMULA CONDENSADA
GEOMETRÍA MOLECULAR:
Es la distribución tridimensional de los átomos de una molécula. Indica la orientación espacial de los átomos que forman la molécula. Así obtenemos diversas formas: Lineales, Tetraédricas, Octaédricas, Angular, Trigonal, Piramidal, Hexagonal, etc. (BUSCAR FIGURAS EN INTERNET)
H- CARACTERÍSTICAS DE LOS COMPUESTOS ORGÁNICOS E INORGÁNICOS
I- ISÓMEROS
Son compuestos DIFERENTES que poseen la misma fórmula molecular (proporciones) pero difieren de su fórmula estructural o simplificada. Como a pesar de tener la misma proporción de átomos constituyentes se trata de compuestos diferentes, éstos entre ellos tienen propiedades químicas y físicas distintas.
Un ejemplo de isómeros son: El Alcohol Etílico (Etanol) y el Éter dimetílico. Ambos corresponden a la fórmula molecular C2 H6O pero se trata de compuestos con propiedades totalmente diferentes entre sí.
CH3 - CH2 – OH: Corresponde al Etanol; que es un líquido que hierve a 78 °C.
CH3 - O - CH3 corresponde al Éter dimetílico; que es un gas que tiene punto de ebullición de 24 °C.
CH3 – CH2 – CH2 – CH3 BUTANO CH3 – CH – CH3 METILPROPANO
BUTANO
CH3
LABORATORIO DE FACTORES QUE AFECTAN LA SOLUBILIDAD Y LA VELOCIDAD DE DISOLUCIÓN
Para descargar el archivo completo
Click Aquí
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. LABORATORIO DE QUÍMICA 12 º NIVEL: 12 °
Nº LISTA ( menor a mayor ): ________________________________________ Nº LISTA DE LOS AUSENTES: __________________________
FACTORES QUE AFECTAN LA SOLUBILIDAD Y LA VELOCIDAD DE DISOLUCIÓN ( I PARTE ).
Objetivos:
Comprobar que la naturaleza del soluto y del solvente influyen en la solubilidad.
- Identificar algunos de los principales factores que afectan la velocidad de disolución.
- Diferenciar entre solubilidad. y velocidad de disolución.
Utensilios: Gradillas para tubos de ensayo, Tubos de ensayo, Vasos químicos, Espátulas.
Reactivos: Cristales de Yodo ( I2 ), Sulfato cúprico (CuSO4) granulado; Azúcar (Sacarosa), Aceite de cocina,
Sal de cocina ( NaCl ), Parafina triturada (Cera de las velas), Bolitas de Naftaleno (C10H8), Agua, Alcohol, Tetracloruro de carbono (CCl4).
I PARTE. FACTORES QUE AFECTAN LA SOLUBILIDAD
NOTA: EL TETRACLORURO DE CARBONO ES TÓXICO Y VOLÁTIL DE MANERA QUE EL PROFESOR REALIZARÁ PREVIAMENTE LAS PARTES DONDE DEBE EMPLEARSE ESTE SOLVENTE PARA QUE SÓLO SEA DEMOSTRATIVA.
ESTE SOLVENTE ES SUMAMENTE INFLAMABLE. CUIDADO CON LOS MECHEROS.
CUANDO EL ESTUDIANTE DISPONGA TUBOS DE ENSAYO CON CCl4 INMEDIATAMENTE DEBE TAPAR CON PAPEL PARAFINA.
AL FINALIZAR LA EXPERIENCIA EL CCl4 USADO DEBE SER VERTIDO AL VASO QUÍMICO DE DESECHOS INDICADO POR EL PROFESOR. NO LO BOTE EN LA PLUMA DE AGUA. LOS SÓLIDOS PRECIPITADOS SE RECOGEN EN UN PAPEL TOALLA Y LOS ARROJAN A LA BASURA.
A- NATURALEZA DEL SOLVENTE:
1- Observe el tubo de ensayo preparado previamente por el Profesor, donde ha combinado Agua con
Tetracloruro de carbono (CCl4). Realice sus observaciones sobre la densidad de cada compuesto
(capa superior o inferior en el tubo).
2- Esté pendiente a los dos tubos de ensayo preparados previamente por el Profesor, donde ha disuelto
Cristales de Yodo (I2) , en un tubo con Agua y en otro tubo de ensayo con Tetracloruro de carbono (CCl4).
Realice sus observaciones sobre los colores de las soluciones de Yodo. La intensidad de las soluciones
dependerá de la capacidad del solvente de dispersar los cristales de Yodo.
3- De igual forma observe los dos tubos de ensayo preparados previamente por el Profesor, donde ha disuelto
Cristales de Sulfato cúprico granulado (CuSO4), en un tubo con Agua y en otro tubo de ensayo con
Tetracloruro de carbono (CCl4). Realice sus observaciones sobre los colores de las soluciones de Sulfato
cúprico. La intensidad de las soluciones dependerá de la capacidad del solvente de dispersar los
cristales de Sulfato cúprico.
4- Observe el tubo de ensayo preparado previamente por el Profesor, donde ha combinado Agua con
Tetracloruro de carbono (CCl4) y a esta mezcla le ha agregado algunos Cristales de Yodo (I2).
Realice sus observaciones sobre la capacidad de ser miscibles (solubles) ambos compuestos, y sobre
la densidad de cada uno (capa superior o inferior en el tubo).
5- Observe el tubo de ensayo preparados previamente por el Profesor, donde ha combinado Agua con
Tetracloruro de carbono (CCl4) y a esta mezcla le ha agregado algunos Cristales de Sulfato cúprico
granulado (CuSO4).
Realice sus observaciones sobre la capacidad de ser miscibles (solubles) ambos compuestos, y sobre
la densidad de cada uno (capa superior o inferior en el tubo).
6- Observe el tubo de ensayo preparado previamente por el Profesor, donde ha combinado Agua con
Aceite de cocina. Realice sus observaciones sobre la capacidad de ser miscibles (solubles) ambos
compuestos, y sobre la densidad de cada uno (capa superior o inferior en el tubo).
7- Disponga (EL ESTUDIANTE) un tubo de ensayo (BIEN SECO) con el solvente Tetracloruro de
carbono, hasta 1/4 del volumen del tubo de ensayo. Adicione Aceite de cocina en una cantidad que sea un
poco menos de 1 /4 de volumen del tubo. Agite el tubo con la mezcla y trate de disolverla.
Realice sus observaciones sobre la capacidad de ser miscibles (solubles) ambos compuestos.
B- NATURALEZA DEL SOLUTO:
1- Esté pendiente a los dos tubos de ensayo preparados previamente por el Profesor, donde ha combinado con
Tetracloruro de carbono (CCl4) una pequeña cantidad de los siguientes solutos: Sacarosa (Azúcar de
mesa); Cloruro de sodio (Sal de cocina ).
Realice sus observaciones sobre la solubilidad de estos solutos en el solvente (CCl4).
RECUERDE SEGÚN SU EXPERIENCIA DE CASA LA SOLUBILIDAD DE ESTOS SOLUTOS EN AGUA.
2- De igual forma observe los dos tubos de ensayo preparados previamente por el Profesor, donde ha
combinado con Agua los siguientes solutos: Parafina triturada (Cera de las velas) y Bolitas de Naftaleno
trituradas (C10H8). Realice sus observaciones sobre la solubilidad de estos solutos en el solvente Agua.
3- Disponga (EL ESTUDIANTE) dos tubos de ensayo (BIEN SECOS) con el solvente Tetracloruro de
carbono (CCl4), hasta 1/4 del volumen de los tubos de ensayo. Agregue a uno de los tubos una pequeña
cantidad de Parafina triturada (Cera de las velas) y al otro tubo una pequeña cantidad de Bolitas de
Naftaleno trituradas (C10H8). Agite los tubos de ensayo con los solutos y trate de disolverlos.
Realice sus observaciones sobre la solubilidad de estos soluto en el solvente Tetracloruro de carbono
(CCl4),
4- Disponga (EL ESTUDIANTE) cuatro tubos de ensayo con el solvente Alcohol, hasta 1/4 del
volumen de los tubos de ensayo. Agregue respectivamente a estos tubos una pequeña cantidad de los
siguientes solutos: Sacarosa (Azúcar de mesa); Cloruro de sodio (Sal de cocina ), Parafina (Cera de las
velas) y Bolitas de Naftaleno trituradas (C10H8). Agite los tubos de ensayo con los solutos y trate de
disolverlos. Realice sus observaciones sobre la solubilidad de estos solutos en el solvente (Alcohol).
II PARTE. FACTORES QUE AFECTAN LA VELOCIDAD DE DISOLUCIÓN
A- EFECTO DEL MOVIMIENTO DE AGITACIÓN:
1- Disponga (EL ESTUDIANTE) dos tubos de ensayo con el solvente Agua, hasta 1/4 del volumen
de los tubos de ensayo. Coloque pequeñas cantidades iguales de Sulfato de cobre granulado (CuSO4) en
cada uno de los tubos de ensayo con agua. Tape y agite vigorosamente uno de los tubos, mientras el otro
tubo permanece en reposo.
Realice sus observaciones sobre la Velocidad de disolución del soluto en cada caso.
B- EFECTO DEL TAMAÑO DE LAS PARTÍCULAS:
1- Disponga (EL ESTUDIANTE) dos tubos de ensayo (BIEN SECOS) con el solvente Tetracloruro de
carbono (CCl4), hasta 1/4 del volumen de los tubos de ensayo. Coloque una Bolita de Naftaleno ENTERA
(C10H8); y en otro una cantidad aproximadamente igual en peso de una Bolita de Naftaleno TRITURADA
(C10H8). Tape y agite vigorosamente los dos tubos de ensayo.
Realice sus observaciones sobre la Velocidad de disolución del soluto en cada caso.
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. LABORATORIO DE QUÍMICA 12 º NIVEL: 12 °
Nº LISTA ( menor a mayor ): ________________________________________ Nº LISTA DE LOS AUSENTES: __________________________
FACTORES QUE AFECTAN LA SOLUBILIDAD Y LA VELOCIDAD DE DISOLUCIÓN ( I PARTE ).
TALLER DE LABORATORIO
I PARTE. FACTORES QUE AFECTAN LA SOLUBILIDAD
1- Explique detalladamente cuál fue el mejor solvente para los cristales de Yodo (I2) en esta experiencia . Justifique, según la experiencia realizada, esta observación, refiriéndose a las intensidades del color de las soluciones obtenidas según la capacidad de dispersión de los cristales de Yodo (I2) en los dos solventes ensayados (Agua y CCl4 ).
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
2- Llene el siguiente cuadro con la información requerida sobre la solubilidad de los diferentes solutos en los solventes
ensayados, de acuerdo a la Naturaleza polar o No polar de las sustancias.
SOLUTO Solubilidad
en H2O
Sí / No Solubilidad en
CCl4
Sí / No Solubilidad en
Alcohol
Sí / No Compuesto Polar / No Polar Compuesto Iónico / Covalente
H2O —
CCl4 —
Cristales de I2 —
CuSO4 —
Aceite de Cocina
Azúcar de mesa
Sal de cocina
Parafina
C10H8
3- Dé una explicación del por qué usted cree los tubos de ensayos deben estar completamente secos al añadir el CCl4.
__________________________________________________________________________________________________
__________________________________________________________________________________________________
4- Investiga qué es un Aceite ( su naturaleza química ) y que es la Parafina (Cera de las velas).
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
5- Qué se quiere decir cuando expresamos: “ Lo igual disuelve lo igual ”. Justifique su respuesta basados en los resultados
de esta experiencia de laboratorio.
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
II PARTE. FACTORES QUE AFECTAN LA VELOCIDAD DE DISOLUCIÓN
1- Compare sus observaciones referentes al efecto de la agitación sobre la velocidad de disolución
en agua del Sulfato cúprico granulado (CuSO4). Justifique su comparación basado en la experiencia de
laboratorio. ¿ Qué ocurrió en ambos casos con la Velocidad de disolución del Sulfato cúprico granulado ? ¿ Por qué ?
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
2- Describa los efectos que presentó el tamaño de las partículas ( Bolitas de Naftaleno Enteras y pulverizadas (C10H8 )) en la
velocidad de disolución de este soluto en el Tetracloruro de carbono (CCl4). Justifique su descripción según lo observado
en la experiencia de laboratorio. ¿ Qué ocurrió en ambos casos con la Velocidad de disolución de las Bolitas de
Naftaleno Enteras y pulverizadas (C10H8 ) ? ¿ Por qué ?
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
Click Aquí
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. LABORATORIO DE QUÍMICA 12 º NIVEL: 12 °
Nº LISTA ( menor a mayor ): ________________________________________ Nº LISTA DE LOS AUSENTES: __________________________
FACTORES QUE AFECTAN LA SOLUBILIDAD Y LA VELOCIDAD DE DISOLUCIÓN ( I PARTE ).
Objetivos:
Comprobar que la naturaleza del soluto y del solvente influyen en la solubilidad.
- Identificar algunos de los principales factores que afectan la velocidad de disolución.
- Diferenciar entre solubilidad. y velocidad de disolución.
Utensilios: Gradillas para tubos de ensayo, Tubos de ensayo, Vasos químicos, Espátulas.
Reactivos: Cristales de Yodo ( I2 ), Sulfato cúprico (CuSO4) granulado; Azúcar (Sacarosa), Aceite de cocina,
Sal de cocina ( NaCl ), Parafina triturada (Cera de las velas), Bolitas de Naftaleno (C10H8), Agua, Alcohol, Tetracloruro de carbono (CCl4).
I PARTE. FACTORES QUE AFECTAN LA SOLUBILIDAD
NOTA: EL TETRACLORURO DE CARBONO ES TÓXICO Y VOLÁTIL DE MANERA QUE EL PROFESOR REALIZARÁ PREVIAMENTE LAS PARTES DONDE DEBE EMPLEARSE ESTE SOLVENTE PARA QUE SÓLO SEA DEMOSTRATIVA.
ESTE SOLVENTE ES SUMAMENTE INFLAMABLE. CUIDADO CON LOS MECHEROS.
CUANDO EL ESTUDIANTE DISPONGA TUBOS DE ENSAYO CON CCl4 INMEDIATAMENTE DEBE TAPAR CON PAPEL PARAFINA.
AL FINALIZAR LA EXPERIENCIA EL CCl4 USADO DEBE SER VERTIDO AL VASO QUÍMICO DE DESECHOS INDICADO POR EL PROFESOR. NO LO BOTE EN LA PLUMA DE AGUA. LOS SÓLIDOS PRECIPITADOS SE RECOGEN EN UN PAPEL TOALLA Y LOS ARROJAN A LA BASURA.
A- NATURALEZA DEL SOLVENTE:
1- Observe el tubo de ensayo preparado previamente por el Profesor, donde ha combinado Agua con
Tetracloruro de carbono (CCl4). Realice sus observaciones sobre la densidad de cada compuesto
(capa superior o inferior en el tubo).
2- Esté pendiente a los dos tubos de ensayo preparados previamente por el Profesor, donde ha disuelto
Cristales de Yodo (I2) , en un tubo con Agua y en otro tubo de ensayo con Tetracloruro de carbono (CCl4).
Realice sus observaciones sobre los colores de las soluciones de Yodo. La intensidad de las soluciones
dependerá de la capacidad del solvente de dispersar los cristales de Yodo.
3- De igual forma observe los dos tubos de ensayo preparados previamente por el Profesor, donde ha disuelto
Cristales de Sulfato cúprico granulado (CuSO4), en un tubo con Agua y en otro tubo de ensayo con
Tetracloruro de carbono (CCl4). Realice sus observaciones sobre los colores de las soluciones de Sulfato
cúprico. La intensidad de las soluciones dependerá de la capacidad del solvente de dispersar los
cristales de Sulfato cúprico.
4- Observe el tubo de ensayo preparado previamente por el Profesor, donde ha combinado Agua con
Tetracloruro de carbono (CCl4) y a esta mezcla le ha agregado algunos Cristales de Yodo (I2).
Realice sus observaciones sobre la capacidad de ser miscibles (solubles) ambos compuestos, y sobre
la densidad de cada uno (capa superior o inferior en el tubo).
5- Observe el tubo de ensayo preparados previamente por el Profesor, donde ha combinado Agua con
Tetracloruro de carbono (CCl4) y a esta mezcla le ha agregado algunos Cristales de Sulfato cúprico
granulado (CuSO4).
Realice sus observaciones sobre la capacidad de ser miscibles (solubles) ambos compuestos, y sobre
la densidad de cada uno (capa superior o inferior en el tubo).
6- Observe el tubo de ensayo preparado previamente por el Profesor, donde ha combinado Agua con
Aceite de cocina. Realice sus observaciones sobre la capacidad de ser miscibles (solubles) ambos
compuestos, y sobre la densidad de cada uno (capa superior o inferior en el tubo).
7- Disponga (EL ESTUDIANTE) un tubo de ensayo (BIEN SECO) con el solvente Tetracloruro de
carbono, hasta 1/4 del volumen del tubo de ensayo. Adicione Aceite de cocina en una cantidad que sea un
poco menos de 1 /4 de volumen del tubo. Agite el tubo con la mezcla y trate de disolverla.
Realice sus observaciones sobre la capacidad de ser miscibles (solubles) ambos compuestos.
B- NATURALEZA DEL SOLUTO:
1- Esté pendiente a los dos tubos de ensayo preparados previamente por el Profesor, donde ha combinado con
Tetracloruro de carbono (CCl4) una pequeña cantidad de los siguientes solutos: Sacarosa (Azúcar de
mesa); Cloruro de sodio (Sal de cocina ).
Realice sus observaciones sobre la solubilidad de estos solutos en el solvente (CCl4).
RECUERDE SEGÚN SU EXPERIENCIA DE CASA LA SOLUBILIDAD DE ESTOS SOLUTOS EN AGUA.
2- De igual forma observe los dos tubos de ensayo preparados previamente por el Profesor, donde ha
combinado con Agua los siguientes solutos: Parafina triturada (Cera de las velas) y Bolitas de Naftaleno
trituradas (C10H8). Realice sus observaciones sobre la solubilidad de estos solutos en el solvente Agua.
3- Disponga (EL ESTUDIANTE) dos tubos de ensayo (BIEN SECOS) con el solvente Tetracloruro de
carbono (CCl4), hasta 1/4 del volumen de los tubos de ensayo. Agregue a uno de los tubos una pequeña
cantidad de Parafina triturada (Cera de las velas) y al otro tubo una pequeña cantidad de Bolitas de
Naftaleno trituradas (C10H8). Agite los tubos de ensayo con los solutos y trate de disolverlos.
Realice sus observaciones sobre la solubilidad de estos soluto en el solvente Tetracloruro de carbono
(CCl4),
4- Disponga (EL ESTUDIANTE) cuatro tubos de ensayo con el solvente Alcohol, hasta 1/4 del
volumen de los tubos de ensayo. Agregue respectivamente a estos tubos una pequeña cantidad de los
siguientes solutos: Sacarosa (Azúcar de mesa); Cloruro de sodio (Sal de cocina ), Parafina (Cera de las
velas) y Bolitas de Naftaleno trituradas (C10H8). Agite los tubos de ensayo con los solutos y trate de
disolverlos. Realice sus observaciones sobre la solubilidad de estos solutos en el solvente (Alcohol).
II PARTE. FACTORES QUE AFECTAN LA VELOCIDAD DE DISOLUCIÓN
A- EFECTO DEL MOVIMIENTO DE AGITACIÓN:
1- Disponga (EL ESTUDIANTE) dos tubos de ensayo con el solvente Agua, hasta 1/4 del volumen
de los tubos de ensayo. Coloque pequeñas cantidades iguales de Sulfato de cobre granulado (CuSO4) en
cada uno de los tubos de ensayo con agua. Tape y agite vigorosamente uno de los tubos, mientras el otro
tubo permanece en reposo.
Realice sus observaciones sobre la Velocidad de disolución del soluto en cada caso.
B- EFECTO DEL TAMAÑO DE LAS PARTÍCULAS:
1- Disponga (EL ESTUDIANTE) dos tubos de ensayo (BIEN SECOS) con el solvente Tetracloruro de
carbono (CCl4), hasta 1/4 del volumen de los tubos de ensayo. Coloque una Bolita de Naftaleno ENTERA
(C10H8); y en otro una cantidad aproximadamente igual en peso de una Bolita de Naftaleno TRITURADA
(C10H8). Tape y agite vigorosamente los dos tubos de ensayo.
Realice sus observaciones sobre la Velocidad de disolución del soluto en cada caso.
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. LABORATORIO DE QUÍMICA 12 º NIVEL: 12 °
Nº LISTA ( menor a mayor ): ________________________________________ Nº LISTA DE LOS AUSENTES: __________________________
FACTORES QUE AFECTAN LA SOLUBILIDAD Y LA VELOCIDAD DE DISOLUCIÓN ( I PARTE ).
TALLER DE LABORATORIO
I PARTE. FACTORES QUE AFECTAN LA SOLUBILIDAD
1- Explique detalladamente cuál fue el mejor solvente para los cristales de Yodo (I2) en esta experiencia . Justifique, según la experiencia realizada, esta observación, refiriéndose a las intensidades del color de las soluciones obtenidas según la capacidad de dispersión de los cristales de Yodo (I2) en los dos solventes ensayados (Agua y CCl4 ).
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
2- Llene el siguiente cuadro con la información requerida sobre la solubilidad de los diferentes solutos en los solventes
ensayados, de acuerdo a la Naturaleza polar o No polar de las sustancias.
SOLUTO Solubilidad
en H2O
Sí / No Solubilidad en
CCl4
Sí / No Solubilidad en
Alcohol
Sí / No Compuesto Polar / No Polar Compuesto Iónico / Covalente
H2O —
CCl4 —
Cristales de I2 —
CuSO4 —
Aceite de Cocina
Azúcar de mesa
Sal de cocina
Parafina
C10H8
3- Dé una explicación del por qué usted cree los tubos de ensayos deben estar completamente secos al añadir el CCl4.
__________________________________________________________________________________________________
__________________________________________________________________________________________________
4- Investiga qué es un Aceite ( su naturaleza química ) y que es la Parafina (Cera de las velas).
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
5- Qué se quiere decir cuando expresamos: “ Lo igual disuelve lo igual ”. Justifique su respuesta basados en los resultados
de esta experiencia de laboratorio.
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
II PARTE. FACTORES QUE AFECTAN LA VELOCIDAD DE DISOLUCIÓN
1- Compare sus observaciones referentes al efecto de la agitación sobre la velocidad de disolución
en agua del Sulfato cúprico granulado (CuSO4). Justifique su comparación basado en la experiencia de
laboratorio. ¿ Qué ocurrió en ambos casos con la Velocidad de disolución del Sulfato cúprico granulado ? ¿ Por qué ?
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
2- Describa los efectos que presentó el tamaño de las partículas ( Bolitas de Naftaleno Enteras y pulverizadas (C10H8 )) en la
velocidad de disolución de este soluto en el Tetracloruro de carbono (CCl4). Justifique su descripción según lo observado
en la experiencia de laboratorio. ¿ Qué ocurrió en ambos casos con la Velocidad de disolución de las Bolitas de
Naftaleno Enteras y pulverizadas (C10H8 ) ? ¿ Por qué ?
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
__________________________________________________________________________________________________
sábado, 27 de marzo de 2010
PARA DESCARGAR EL ARCHIVO ORIGINAL:
Click aquí
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 °
TEMa: LAS SOLUCIONES n° 2
( HACER TODO EN EL CARTAPACIO DE QUÍMICA)
(PARA LOS CÁLCULOS RECORDAR QUE LA DENSIDAD DEL AGUA ES: 1.00 g H2O / 1.00 mL H2O)
I PARTE. A continuación se presentarán a determinadas temperaturas, las MÁXIMAS Solubilidades de ciertos solutos por cada 100 gramos de Agua. Considere cada uno de los 5 EVENTOS que se presentan y llene el CUADRO adjunto con la información requerida. Tipo de Solución ( No Saturada, Saturada y Sobresaturada); Equilibrio Dinámico ( Use (+) para Mayor, (–) para Menor, (=) para igual ).
1- Solubilidad del Cloruro de sodio a 20 ºC: 36 g sal binaria / 100 g Agua. A 20 ºC una persona disuelve 25 g de la sal binaria en 100 gramos de agua.
2- Solubilidad del Cloruro de potasio a 20 ºC: 34 g sal binaria / 100 g Agua. A 20 ºC en el laboratorio de Química, un estudiante mezcla 50 g de la sal binaria en 100 mL de agua. ( NOTA: Se obtiene Precipitado. Para evaluar el Tipo de Solución considere solamente la solución líquida sobrenadante (arriba del precipitado) ).
3- Solubilidad del Fosfato de sodio a 140 ºF: 50 g oxosal / 100 g Agua. A 302 ºF un estudiante disuelve completamente 100 g de la oxosal en 100 gramos de agua. ( NOTA: NO Se obtiene precipitado)
4- Solubilidad del Trinitrato (V) de sodio a 50 ºC: 114 g oxosal / 100 g Agua. A 50 ºC una persona disuelve 228 g de la oxosal en 0.20 L de agua.
5- Solubilidad del Yoduro de potasio a 313 ºK: 156 g sal binaria / 100 g Agua. A 313 ºK una persona prepara una solución disolviendo 0.10 Kg de la sal binaria en 100 mL de agua.
EVENTO Nº TIPO DE SOLUCIÓN VELOC. DISOLUCIÓN VELOC. CRISTALIZACIÓN
1
2
3
4
5
II PARTE. Responda a las siguientes preguntas basados en los eventos planteados en la I PARTE.
evento nº 1
a) Si en este evento la temperatura del agua aumenta desde 20 ºC hasta 40 ºC; la Velocidad de Disolución de los 25 g de Cloruro de sodio en agua ; ¿ Aumentaría o disminuiría ?
b) Si la temperatura disminuye desde 20 ºC hasta 10 ºC; ¿ Se podrían disolver completamente en agua los 25 g de Cloruro de sodio? Sí / No. ¿Por qué?
evento nº 2
a) A una temperatura de 20 ºC; ¿ Cuántos gramos de los 50 g de Cloruro de potasio se disolverán completamente en agua ?.
b) A una temperatura de 20 ºC; ¿ Cuántos gramos de los 50 g de Cloruro de potasio se depositarían en el fondo del recipiente (Precipitado) en donde esté la solución acuosa de la sal binaria ?.
c) A una temperatura de 20 ºC; si AUMENTAMOS la PRESIÓN a la que se encuentra el sistema de Solución KCl / H2O,
¿Se beneficiaría la velocidad de disolución de la sal binaria (KCl) en agua ?. Sí / No. ¿Por qué?
evento nº 3
a) ¿ Qué ocurriría con los 100 gramos de Fosfato de sodio una vez la temperatura disminuya desde 302 ºF hasta 140 ºF ?
¿Aumentaría su disolución en agua ?¿Precipitaría toda la masa de la oxosal ? ¿ Precipitaría una parte de la masa ?
b) ¿ Cuántos gramos de Fosfato de sodio permanecerá en solución a 140 ºF ?.
c) ¿ Cuántos gramos de Fosfato de sodio precipitarían hacia el fondo del recipiente a 140 ºF ?.
evento nº 4
a) A 50 ºC; ¿ Cuántos gramos de agua se requieren para disolver 342 g de Trinitrato (V) de sodio y mantener el mismo tipo de solución que usted evaluó en el cuadro ?.
b) A 50 ºC; ¿ Cuántos gramos de Trinitrato (V) se pueden disolver en 1.00 L de agua y mantener el mismo tipo de solución que usted evaluó en el cuadro ?.
c) A una temperatura de 50 ºC; si DISMINUÍMOS la PRESIÓN a la que se encuentra el sistema de Solución KCl / H2O,
¿Se beneficiaría la velocidad de disolución de la sal binaria (KCl) en agua ?. Sí / No. ¿Por qué?
evento nº 5
a) Si en este evento la temperatura del agua decrece desde 313 ºK hasta 293 ºK; ¿ Qué ocurriría con la Velocidad de Cristalización de los 0.10 Kg del Yoduro de potasio en los 100 mL de agua ? ¿Aumentaría o disminuiría ?
b) A una temperatura de 40 ºC; ¿Cuántos gramos de los 0.10 Kg de KI se disuelve como Máximo en los 100 mL de agua ?
b) A una temperatura de 313 ºK; ¿Cuántos gramos le hacen falta a los 0.10 Kg de KI para alcanzar el LÍMITE DE SOLUBILIDAD del KI en agua ?.
III PARTE. A continuación se presentarán diversos eventos de solubilidad de gases en líquidos a determinadas condiciones de temperatura y presión. Considere cada uno de los EVENTOS que se presentan y llene el CUADRO adjunto con la información requerida.
Densidad del gas (Soluto) ( Use (+) para Alta; (–) para Baja ). Volumen del gas ( Use (+) para Aumentó, (–) para Disminuyó ). Solubilidad del gas ( Use (+) para Aumenta; (–) para Disminuye )
1- Una pareja de recién casados celebran su luna de miel solicitando al hotel donde se hospedan una Champaña helada.
Cuando reciben el pedido, por error del camarero, les entregan la botella de Champaña ya descorchada (destapada) y a temperatura ambiente (sin haberla enfriado previamente). Cuando la pareja prueba la Champaña la sienten insípida.
2- Un estudiante de 12º del Colegio, abre a la hora del RECREO, una lata de Soda BIEN Fría y el líquido NO brota con espuma desde dentro de la lata.
3- Los buzos emplean para respirar, en sus rutinas, tanques de Aire comprimido (mezcla gaseosa de Nitrógeno- Oxígeno). Conforme el buzo se sumerge a grandes profundidades marinas los gases respirados pasan a dispersarse completamente en la sangre.
4- En un lago situado a 5500 m de altura sobre el nivel del mar, encontramos menos Oxígeno, que si el lago estuviera a nivel del mar.
5- El mal olor provocado por una flatulencia (producto de dietas alimenticias ricas en azufre), se percibe más fuerte en un salón de clases con el aire acondicionado dañado. NOTA: El gas flatulento actúa como soluto / El aire del medio es el solvente.
EVENTO Nº DENSID. GAS (SOLUTO) VOLUMEN DEL GAS SOLUBILIDAD DEL GAS
1
2
3
4
5
IV PARTE. Justifique o Cuestione, con una explicación basada en los temas tratados en clases, los siguientes enunciados.
1- Una bolita blanca de Naftaleno (C10 H8) que sirve para las polillas, se disuelve más rápido en Tetracloruro de carbono (CCl4), que si intentamos disolver el Naftaleno en forma triturada (machacado).
2- La Sacarosa o azúcar de mesa (C12H22O11) se disuelve lentamente si endulzamos (empleando una cucharada) un Té que contiene cubitos de hielo, que otro Té que está tibio.
3- Una solución acuosa que tiene Precipitado (sólido en el fondo del recipiente que la contiene) es considerada: “ Una Solución Sobresaturada ”.
4- A nivel del mar la Presión atmosférica es de 1.00 Atmósferas ó 760 Torr. Si ascendemos hasta la cima de una montaña que está a 8000 m por encima del nivel del mar y allá arriba destapamos una lata de soda; entonces se observaría que el líquido de la soda brotaría con más espuma que si abriéramos la lata de soda a nivel del mar.
5- Cuando los buzos ascienden desde las profundidades marinas deben hacerlo calmadamente (muy lento) para que los gases disueltos en la sangre sean eliminados vía pulmonar. Si emergen a la superficie muy rápido los gases disueltos en la sangre formarían burbujas que causarían obstrucción de los vasos sanguíneos provocando derrames cerebrales.
(Investigar Aeroembolismos).
6- La sal sólida Nitrato de potasio (KNO3) se disuelve más rápidamente en agua si AUMENTAMOS la PRESIÓN al disolver el KNO3 / H2O.
7- Una solución SATURADA contiene el soluto disuelto en el “LIMITE DE SOLUBILIDAD”.
Click aquí
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 °
TEMa: LAS SOLUCIONES n° 2
( HACER TODO EN EL CARTAPACIO DE QUÍMICA)
(PARA LOS CÁLCULOS RECORDAR QUE LA DENSIDAD DEL AGUA ES: 1.00 g H2O / 1.00 mL H2O)
I PARTE. A continuación se presentarán a determinadas temperaturas, las MÁXIMAS Solubilidades de ciertos solutos por cada 100 gramos de Agua. Considere cada uno de los 5 EVENTOS que se presentan y llene el CUADRO adjunto con la información requerida. Tipo de Solución ( No Saturada, Saturada y Sobresaturada); Equilibrio Dinámico ( Use (+) para Mayor, (–) para Menor, (=) para igual ).
1- Solubilidad del Cloruro de sodio a 20 ºC: 36 g sal binaria / 100 g Agua. A 20 ºC una persona disuelve 25 g de la sal binaria en 100 gramos de agua.
2- Solubilidad del Cloruro de potasio a 20 ºC: 34 g sal binaria / 100 g Agua. A 20 ºC en el laboratorio de Química, un estudiante mezcla 50 g de la sal binaria en 100 mL de agua. ( NOTA: Se obtiene Precipitado. Para evaluar el Tipo de Solución considere solamente la solución líquida sobrenadante (arriba del precipitado) ).
3- Solubilidad del Fosfato de sodio a 140 ºF: 50 g oxosal / 100 g Agua. A 302 ºF un estudiante disuelve completamente 100 g de la oxosal en 100 gramos de agua. ( NOTA: NO Se obtiene precipitado)
4- Solubilidad del Trinitrato (V) de sodio a 50 ºC: 114 g oxosal / 100 g Agua. A 50 ºC una persona disuelve 228 g de la oxosal en 0.20 L de agua.
5- Solubilidad del Yoduro de potasio a 313 ºK: 156 g sal binaria / 100 g Agua. A 313 ºK una persona prepara una solución disolviendo 0.10 Kg de la sal binaria en 100 mL de agua.
EVENTO Nº TIPO DE SOLUCIÓN VELOC. DISOLUCIÓN VELOC. CRISTALIZACIÓN
1
2
3
4
5
II PARTE. Responda a las siguientes preguntas basados en los eventos planteados en la I PARTE.
evento nº 1
a) Si en este evento la temperatura del agua aumenta desde 20 ºC hasta 40 ºC; la Velocidad de Disolución de los 25 g de Cloruro de sodio en agua ; ¿ Aumentaría o disminuiría ?
b) Si la temperatura disminuye desde 20 ºC hasta 10 ºC; ¿ Se podrían disolver completamente en agua los 25 g de Cloruro de sodio? Sí / No. ¿Por qué?
evento nº 2
a) A una temperatura de 20 ºC; ¿ Cuántos gramos de los 50 g de Cloruro de potasio se disolverán completamente en agua ?.
b) A una temperatura de 20 ºC; ¿ Cuántos gramos de los 50 g de Cloruro de potasio se depositarían en el fondo del recipiente (Precipitado) en donde esté la solución acuosa de la sal binaria ?.
c) A una temperatura de 20 ºC; si AUMENTAMOS la PRESIÓN a la que se encuentra el sistema de Solución KCl / H2O,
¿Se beneficiaría la velocidad de disolución de la sal binaria (KCl) en agua ?. Sí / No. ¿Por qué?
evento nº 3
a) ¿ Qué ocurriría con los 100 gramos de Fosfato de sodio una vez la temperatura disminuya desde 302 ºF hasta 140 ºF ?
¿Aumentaría su disolución en agua ?¿Precipitaría toda la masa de la oxosal ? ¿ Precipitaría una parte de la masa ?
b) ¿ Cuántos gramos de Fosfato de sodio permanecerá en solución a 140 ºF ?.
c) ¿ Cuántos gramos de Fosfato de sodio precipitarían hacia el fondo del recipiente a 140 ºF ?.
evento nº 4
a) A 50 ºC; ¿ Cuántos gramos de agua se requieren para disolver 342 g de Trinitrato (V) de sodio y mantener el mismo tipo de solución que usted evaluó en el cuadro ?.
b) A 50 ºC; ¿ Cuántos gramos de Trinitrato (V) se pueden disolver en 1.00 L de agua y mantener el mismo tipo de solución que usted evaluó en el cuadro ?.
c) A una temperatura de 50 ºC; si DISMINUÍMOS la PRESIÓN a la que se encuentra el sistema de Solución KCl / H2O,
¿Se beneficiaría la velocidad de disolución de la sal binaria (KCl) en agua ?. Sí / No. ¿Por qué?
evento nº 5
a) Si en este evento la temperatura del agua decrece desde 313 ºK hasta 293 ºK; ¿ Qué ocurriría con la Velocidad de Cristalización de los 0.10 Kg del Yoduro de potasio en los 100 mL de agua ? ¿Aumentaría o disminuiría ?
b) A una temperatura de 40 ºC; ¿Cuántos gramos de los 0.10 Kg de KI se disuelve como Máximo en los 100 mL de agua ?
b) A una temperatura de 313 ºK; ¿Cuántos gramos le hacen falta a los 0.10 Kg de KI para alcanzar el LÍMITE DE SOLUBILIDAD del KI en agua ?.
III PARTE. A continuación se presentarán diversos eventos de solubilidad de gases en líquidos a determinadas condiciones de temperatura y presión. Considere cada uno de los EVENTOS que se presentan y llene el CUADRO adjunto con la información requerida.
Densidad del gas (Soluto) ( Use (+) para Alta; (–) para Baja ). Volumen del gas ( Use (+) para Aumentó, (–) para Disminuyó ). Solubilidad del gas ( Use (+) para Aumenta; (–) para Disminuye )
1- Una pareja de recién casados celebran su luna de miel solicitando al hotel donde se hospedan una Champaña helada.
Cuando reciben el pedido, por error del camarero, les entregan la botella de Champaña ya descorchada (destapada) y a temperatura ambiente (sin haberla enfriado previamente). Cuando la pareja prueba la Champaña la sienten insípida.
2- Un estudiante de 12º del Colegio, abre a la hora del RECREO, una lata de Soda BIEN Fría y el líquido NO brota con espuma desde dentro de la lata.
3- Los buzos emplean para respirar, en sus rutinas, tanques de Aire comprimido (mezcla gaseosa de Nitrógeno- Oxígeno). Conforme el buzo se sumerge a grandes profundidades marinas los gases respirados pasan a dispersarse completamente en la sangre.
4- En un lago situado a 5500 m de altura sobre el nivel del mar, encontramos menos Oxígeno, que si el lago estuviera a nivel del mar.
5- El mal olor provocado por una flatulencia (producto de dietas alimenticias ricas en azufre), se percibe más fuerte en un salón de clases con el aire acondicionado dañado. NOTA: El gas flatulento actúa como soluto / El aire del medio es el solvente.
EVENTO Nº DENSID. GAS (SOLUTO) VOLUMEN DEL GAS SOLUBILIDAD DEL GAS
1
2
3
4
5
IV PARTE. Justifique o Cuestione, con una explicación basada en los temas tratados en clases, los siguientes enunciados.
1- Una bolita blanca de Naftaleno (C10 H8) que sirve para las polillas, se disuelve más rápido en Tetracloruro de carbono (CCl4), que si intentamos disolver el Naftaleno en forma triturada (machacado).
2- La Sacarosa o azúcar de mesa (C12H22O11) se disuelve lentamente si endulzamos (empleando una cucharada) un Té que contiene cubitos de hielo, que otro Té que está tibio.
3- Una solución acuosa que tiene Precipitado (sólido en el fondo del recipiente que la contiene) es considerada: “ Una Solución Sobresaturada ”.
4- A nivel del mar la Presión atmosférica es de 1.00 Atmósferas ó 760 Torr. Si ascendemos hasta la cima de una montaña que está a 8000 m por encima del nivel del mar y allá arriba destapamos una lata de soda; entonces se observaría que el líquido de la soda brotaría con más espuma que si abriéramos la lata de soda a nivel del mar.
5- Cuando los buzos ascienden desde las profundidades marinas deben hacerlo calmadamente (muy lento) para que los gases disueltos en la sangre sean eliminados vía pulmonar. Si emergen a la superficie muy rápido los gases disueltos en la sangre formarían burbujas que causarían obstrucción de los vasos sanguíneos provocando derrames cerebrales.
(Investigar Aeroembolismos).
6- La sal sólida Nitrato de potasio (KNO3) se disuelve más rápidamente en agua si AUMENTAMOS la PRESIÓN al disolver el KNO3 / H2O.
7- Una solución SATURADA contiene el soluto disuelto en el “LIMITE DE SOLUBILIDAD”.
jueves, 18 de marzo de 2010
LAS SOLUCIONES n° 1
Para Descargar el archivo original
Click aquí
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 °
TEMA: LAS SOLUCIONES n° 1
( HACER TODO EN EL CARTAPACIO DE QUÍMICA)
A- Pepare una lista de 10 SOLUCIONES que sean Productos Comerciales de uso cotidiano (domésticos, personal, estético,
medicinales, etc). Si encuentra la Concentración (Cuantitativa) de estos productos anótelas.
B- Pepare una lista de 10 SOLUCIONES que sean preparadas en el Hogar cotidianamente.
C- Prediga basado en la diferencia de electronegatividades el Tipo de Enlace formado (Iónico, Covalente polar, o
Covalente no polar) y si una Molécula con este enlace es Soluble o No soluble en agua. Si es soluble en agua, entonces
prediga si su interacción es por Disociación de la molécula o por Puente de Hidrógeno.
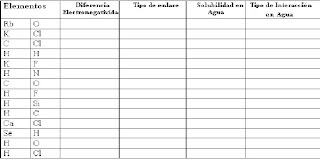
D- Observe estos compuestos y prediga ( teóricamente ) si son Solubles , parcialmente (Ligeramente ) solubles o
insolubles en agua. Sustente sus respuestas.
1- Petróleo
2- Tetracloruro de carbono (Investigue este Compuesto. OJO)
3- CH3NH2
4- Amoníaco gaseoso
5- CH3 (CH2)4 CH3
6- Óxido carbónico
7- C6H12O6 (Glucosa)
8- Cromato férrico
9- CH3 CH2-OH
10- Cloruro de hidrógeno gaseoso (Investigue este Compuesto.OJO)
11- Nitrato de amonio
12- Ácido clorhídrico(Investigue este Compuesto.OJO)
13- CH3-CH2 –OH
14- Eter de Petróleo
15- Hidróxido de magnesio
16- CH3-CH2 -Br
17- Sulfato de calcio
18- OH-CH2 -CH2 -OH
19- Carbonato de calcio
20- Mg (NO3 )2
21- CH3-CH2 -CH2 –F
22- CH3-CH2 –Cl
23- Cloruro de plata
24- Gasolina
25- C12 H22 O11 (Azúcar de Mesa)
26- CH3-CH2-CH2–I
27- Sulfuro de calcio
28- Ácido sulfúrico
E- Investigue y “ Sustente ” si las siguientes aseveraciones son Correctas o Falsas.
1- El Cloruro de sodio ( KCl ) es soluble en agua
2- El Cloruro de sodio (NaCl) es completamente soluble en Etanol ( C2H5 OH ) (Haga la Prueba o Investíguelo)
3- El Tetracloruro de carbono (CCl 4) es miscible en agua
4- El Tetracloruro de carbono es miscible en Benceno ( C6 H6 )
5- El gas Hidrógeno (H2) es soluble en agua
6- El gas Amoníaco es soluble en Hexano (C6 H14)
7- El Naftaleno sólido (Bolitas blancas para las polillas- C10 H8 ) es soluble en agua.
8- La Parafina ( material de las velas ) es soluble en Cloroformo (CHCl3)
F- A partir de las siguientes reacciones químicas ( realizadas en medio acuoso ); escriba en el espacio en blanco la fórmula
química del producto insoluble en agua.
1- Nitrato de plata + Cloruro de sodio R- ________________
2- Sulfato ( VI ) de diamonio + Hidróxido de plomo ( II ) R- ________________
3- Tris ( Dicromato ( VI ) ) de dialuminio + Óxido de potasio R- ________________
4- Sodio metálico libre + Ácido oxálico R- ________________
5- Cloruro de bario + Ácido fosfórico R- ________________
G- Reflexione y responda argumentando a las preguntas que se presentan a continuación.
1- ¿ Existe alguna diferencia al emplear los términos soluble y miscible ? Sí / No . Justifique su elección.
2- Explique por qué si el CO2 y el O 2 son gases No polares ; El CO2 es un poco más soluble en agua que el O 2 .
3- ¿ Qué líquido será mejor disolvente para el Naftaleno sólido (Bolitas blancas para las polillas- C10 H8 ); el agua o
el Tetracloruro de carbono (CCl4) ? Explique.
4- ¿ Qué líquido será mejor disolvente para el Sulfato de amonio; el agua o el Pentano (C5H12) ? Explique.
¿ En qué disolvente el Bromo líquido (Br2 ) líquido tendrá mayor solubilidad ; en agua o Benceno (C6H6)? Explique.
6- ¿ Qué sustancia es más polar el agua o el Etanol (C2H5OH) ?. Sustente su elección
Click aquí
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 °
TEMA: LAS SOLUCIONES n° 1
( HACER TODO EN EL CARTAPACIO DE QUÍMICA)
A- Pepare una lista de 10 SOLUCIONES que sean Productos Comerciales de uso cotidiano (domésticos, personal, estético,
medicinales, etc). Si encuentra la Concentración (Cuantitativa) de estos productos anótelas.
B- Pepare una lista de 10 SOLUCIONES que sean preparadas en el Hogar cotidianamente.
C- Prediga basado en la diferencia de electronegatividades el Tipo de Enlace formado (Iónico, Covalente polar, o
Covalente no polar) y si una Molécula con este enlace es Soluble o No soluble en agua. Si es soluble en agua, entonces
prediga si su interacción es por Disociación de la molécula o por Puente de Hidrógeno.

D- Observe estos compuestos y prediga ( teóricamente ) si son Solubles , parcialmente (Ligeramente ) solubles o
insolubles en agua. Sustente sus respuestas.
1- Petróleo
2- Tetracloruro de carbono (Investigue este Compuesto. OJO)
3- CH3NH2
4- Amoníaco gaseoso
5- CH3 (CH2)4 CH3
6- Óxido carbónico
7- C6H12O6 (Glucosa)
8- Cromato férrico
9- CH3 CH2-OH
10- Cloruro de hidrógeno gaseoso (Investigue este Compuesto.OJO)
11- Nitrato de amonio
12- Ácido clorhídrico(Investigue este Compuesto.OJO)
13- CH3-CH2 –OH
14- Eter de Petróleo
15- Hidróxido de magnesio
16- CH3-CH2 -Br
17- Sulfato de calcio
18- OH-CH2 -CH2 -OH
19- Carbonato de calcio
20- Mg (NO3 )2
21- CH3-CH2 -CH2 –F
22- CH3-CH2 –Cl
23- Cloruro de plata
24- Gasolina
25- C12 H22 O11 (Azúcar de Mesa)
26- CH3-CH2-CH2–I
27- Sulfuro de calcio
28- Ácido sulfúrico
E- Investigue y “ Sustente ” si las siguientes aseveraciones son Correctas o Falsas.
1- El Cloruro de sodio ( KCl ) es soluble en agua
2- El Cloruro de sodio (NaCl) es completamente soluble en Etanol ( C2H5 OH ) (Haga la Prueba o Investíguelo)
3- El Tetracloruro de carbono (CCl 4) es miscible en agua
4- El Tetracloruro de carbono es miscible en Benceno ( C6 H6 )
5- El gas Hidrógeno (H2) es soluble en agua
6- El gas Amoníaco es soluble en Hexano (C6 H14)
7- El Naftaleno sólido (Bolitas blancas para las polillas- C10 H8 ) es soluble en agua.
8- La Parafina ( material de las velas ) es soluble en Cloroformo (CHCl3)
F- A partir de las siguientes reacciones químicas ( realizadas en medio acuoso ); escriba en el espacio en blanco la fórmula
química del producto insoluble en agua.
1- Nitrato de plata + Cloruro de sodio R- ________________
2- Sulfato ( VI ) de diamonio + Hidróxido de plomo ( II ) R- ________________
3- Tris ( Dicromato ( VI ) ) de dialuminio + Óxido de potasio R- ________________
4- Sodio metálico libre + Ácido oxálico R- ________________
5- Cloruro de bario + Ácido fosfórico R- ________________
G- Reflexione y responda argumentando a las preguntas que se presentan a continuación.
1- ¿ Existe alguna diferencia al emplear los términos soluble y miscible ? Sí / No . Justifique su elección.
2- Explique por qué si el CO2 y el O 2 son gases No polares ; El CO2 es un poco más soluble en agua que el O 2 .
3- ¿ Qué líquido será mejor disolvente para el Naftaleno sólido (Bolitas blancas para las polillas- C10 H8 ); el agua o
el Tetracloruro de carbono (CCl4) ? Explique.
4- ¿ Qué líquido será mejor disolvente para el Sulfato de amonio; el agua o el Pentano (C5H12) ? Explique.
¿ En qué disolvente el Bromo líquido (Br2 ) líquido tendrá mayor solubilidad ; en agua o Benceno (C6H6)? Explique.
6- ¿ Qué sustancia es más polar el agua o el Etanol (C2H5OH) ?. Sustente su elección
jueves, 11 de marzo de 2010
Lab. Reacciones I Parte Qm. 2010
Para descargar el documento en limpio
Click Aquí
COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. LABORATORIO DE QUÍMICA 12 º
NIVEL: 12 °
Nº LISTA ( menor a mayor ): ____________________________________________________ Nº LISTA DE LOS AUSENTES: ______________________
Reacciones Químicas ( I Parte )
Materiales: Gradillas, tubos de ensayo, Papel toalla .
Reactivos: Solución de HCl (diluido) , Granallas ( piedras ) de Zn , Solución de CuSO4 , Clavitos o grapas de hierro , Solución de Pb( NO3 )2,, Solución de KI .
Introducción: Para esta primera parte de la experiencia procedemos a estudiar algunos tipos de reacciones. En general pueden considerarse los siguientes tipos de reacciones:
Simple Desplazamiento: Es la unión de un elemento con un compuesto, con liberación de uno de los elementos combinados en el mismo.
Ejemplo: 2 HCl + Fe -------------------------------------- FeCl2 + H2
Doble Desplazamiento o metátesis: Es la reacción entre dos compuestos con intercambio de elementos y formación de dos nuevos compuestos químicamente análogos a los reaccionantes.
Ejemplo: NaNO3 + KCl ------------------------------------ NaCl + KNO3
Procedimiento:
VOLUMEN EMPLEADO EN LOS TUBOS: 1/4 VOLUMEN O LA MITAD DE LA MITAD
A- Reacciones de Simple desplazamiento:
Vierta HCl (diluido) en un tubo de ensayo y agregue una granalla ( piedra) de Zn. Observe y anote todo lo que ocurre.
Coloque un poco de la Solución de CuSO4 (diluido) en un tubo de ensayo e introduzca una grapa de hierro bien pulida y déjelo reposar 10 minutos. Observe y anote lo que sucede.
- NOTA: EL HIERRO DE LA GRAPA AL REACCIONAR LO HACE EMPLEANDO EL MENOR NÚMERO DE OXIDACIÓN.
B- Reacciones de Doble desplazamiento:
Coloque en respectivos tubos de ensayo una solución (diluida) de KI ( 1/4 de volumen ) y en otro una solución (diluida) de Pb( NO3 )2.
Mezcle el contenido de ambos tubos. Observe y anote los resultados.
Taller de Laboratorio PARA RESOLVER QUÍMICA 12º
Reacciones de simple desplazamiento:
Mencione lo que observa al reaccionar HCl (diluido) con la granalla ( piedra) de cinc .
_________________________________________________________________
¿ El Zn que reaccionó con el HCl ( diluido ) (según el cambio del Nª de Oxidación en la reacción) se Oxida o se Reduce en esta reacción ?
_____________________________________________________________________
Explique su respuesta (basados en el cambio del Número de oxidación del Zn durante la reacción )
______________________________________________________________________
La reacción química estudiada calienta el tubo de ensayo durante este proceso ?: Sí / No ___________________________________________________
- ¿ Qué nombre reciben las reacciones que liberan calor durante el proceso ?: ____________________________________________________________
El gas que se desprendió en esta reacción es: ______________________________________________________________________
Explique por qué la granalla de cinc cambia de color durante su reacción con la solución de HCl.
_______________________________________________________________________
Justifique por qué se humedece la parte superior interior del tubo de ensayo durante la reacción ( ¿Qué se formó? ¿Cómo se formó?):
__________________________________________________________________________
________________________________________________________________________
Escriba la correcta ecuación química balanceada del proceso:_________________________________________________________________________
Mencione dos evidencias experimentales que lo llevan a concluir que hubo una reacción entre el HCl y el Zn.
a- __________________________________________________________________________
b- ________________________________________________________________________
Mencione lo que observa al añadir la grapa de hierro pulida en la Solución de CuSO4 por 10 minutos.
___________________________________________________________________
- ¿Cuál es el precipitado sólido que se deposita sobre la grapa de hierro a los 10 minutos ?: ________________________________________________
- ¿ Qué color presenta este precipitado ? ____________________________________________________________________
- ¿El hierro de la grapa del Número de oxidación del Fe durante la reacción )
__________________________________________________________________
Escriba la ecuación química de esta reacción correctamente balanceada ( utilice el Fe con el menor número de oxidación):
______________________________________________________________
Mencione dos evidencias experimentales que lo llevan a concluir que hubo reacción entre el Fe y CuSO4 .
a- ____________________________________________________________________
b- ____________________________________________________________________
Reacciones de doble desplazamiento:
- Mencione lo que observa al mezclar la Solución de KI con la Solución de Pb( NO3 )2 :
_______________________________________________________________________
- Fórmula química del producto de la reacción insoluble en agua ( precipitado): ___________________________________________________________
- Fórmula química del producto de la reacción soluble en agua ________________________________________________________________________
- Escriba la ecuación química balanceada para esta reacción: _________________________________________________________________________
Justifique la coloración amarilla de la solución resultante final ( Investigue el color de los productos obtenidos ).
___________________________________________________________________
Mencione dos evidencias experimentales que lo llevan a concluir que hubo reacción entre el KI y Pb(NO3)2
a- ____________________________________________________________________
b- _______________________________________________________________________
INVESTIGUE:
¿ Qué entendemos por Oxidación ?
______________________________________________________________________
Defina Reducción:
______________________________________________________________________
¿ Qué es una reacción de Óxido – Reducción ?:
______________________________________________________________________
Explique por qué todas las reacciones de Simple desplazamiento pueden ser consideradas como reacciones de Óxido – Reducción ( REDOX ).
_____________________________________________________________________
Explique por qué las reacciones de Combustión son consideradas reacciones REDOX ?:
______________________________________________________________________
Click Aquí
COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. LABORATORIO DE QUÍMICA 12 º
NIVEL: 12 °
Nº LISTA ( menor a mayor ): ____________________________________________________ Nº LISTA DE LOS AUSENTES: ______________________
Reacciones Químicas ( I Parte )
Materiales: Gradillas, tubos de ensayo, Papel toalla .
Reactivos: Solución de HCl (diluido) , Granallas ( piedras ) de Zn , Solución de CuSO4 , Clavitos o grapas de hierro , Solución de Pb( NO3 )2,, Solución de KI .
Introducción: Para esta primera parte de la experiencia procedemos a estudiar algunos tipos de reacciones. En general pueden considerarse los siguientes tipos de reacciones:
Simple Desplazamiento: Es la unión de un elemento con un compuesto, con liberación de uno de los elementos combinados en el mismo.
Ejemplo: 2 HCl + Fe -------------------------------------- FeCl2 + H2
Doble Desplazamiento o metátesis: Es la reacción entre dos compuestos con intercambio de elementos y formación de dos nuevos compuestos químicamente análogos a los reaccionantes.
Ejemplo: NaNO3 + KCl ------------------------------------ NaCl + KNO3
Procedimiento:
VOLUMEN EMPLEADO EN LOS TUBOS: 1/4 VOLUMEN O LA MITAD DE LA MITAD
A- Reacciones de Simple desplazamiento:
Vierta HCl (diluido) en un tubo de ensayo y agregue una granalla ( piedra) de Zn. Observe y anote todo lo que ocurre.
Coloque un poco de la Solución de CuSO4 (diluido) en un tubo de ensayo e introduzca una grapa de hierro bien pulida y déjelo reposar 10 minutos. Observe y anote lo que sucede.
- NOTA: EL HIERRO DE LA GRAPA AL REACCIONAR LO HACE EMPLEANDO EL MENOR NÚMERO DE OXIDACIÓN.
B- Reacciones de Doble desplazamiento:
Coloque en respectivos tubos de ensayo una solución (diluida) de KI ( 1/4 de volumen ) y en otro una solución (diluida) de Pb( NO3 )2.
Mezcle el contenido de ambos tubos. Observe y anote los resultados.
Taller de Laboratorio PARA RESOLVER QUÍMICA 12º
Reacciones de simple desplazamiento:
Mencione lo que observa al reaccionar HCl (diluido) con la granalla ( piedra) de cinc .
_________________________________________________________________
¿ El Zn que reaccionó con el HCl ( diluido ) (según el cambio del Nª de Oxidación en la reacción) se Oxida o se Reduce en esta reacción ?
_____________________________________________________________________
Explique su respuesta (basados en el cambio del Número de oxidación del Zn durante la reacción )
______________________________________________________________________
La reacción química estudiada calienta el tubo de ensayo durante este proceso ?: Sí / No ___________________________________________________
- ¿ Qué nombre reciben las reacciones que liberan calor durante el proceso ?: ____________________________________________________________
El gas que se desprendió en esta reacción es: ______________________________________________________________________
Explique por qué la granalla de cinc cambia de color durante su reacción con la solución de HCl.
_______________________________________________________________________
Justifique por qué se humedece la parte superior interior del tubo de ensayo durante la reacción ( ¿Qué se formó? ¿Cómo se formó?):
__________________________________________________________________________
________________________________________________________________________
Escriba la correcta ecuación química balanceada del proceso:_________________________________________________________________________
Mencione dos evidencias experimentales que lo llevan a concluir que hubo una reacción entre el HCl y el Zn.
a- __________________________________________________________________________
b- ________________________________________________________________________
Mencione lo que observa al añadir la grapa de hierro pulida en la Solución de CuSO4 por 10 minutos.
___________________________________________________________________
- ¿Cuál es el precipitado sólido que se deposita sobre la grapa de hierro a los 10 minutos ?: ________________________________________________
- ¿ Qué color presenta este precipitado ? ____________________________________________________________________
- ¿El hierro de la grapa del Número de oxidación del Fe durante la reacción )
__________________________________________________________________
Escriba la ecuación química de esta reacción correctamente balanceada ( utilice el Fe con el menor número de oxidación):
______________________________________________________________
Mencione dos evidencias experimentales que lo llevan a concluir que hubo reacción entre el Fe y CuSO4 .
a- ____________________________________________________________________
b- ____________________________________________________________________
Reacciones de doble desplazamiento:
- Mencione lo que observa al mezclar la Solución de KI con la Solución de Pb( NO3 )2 :
_______________________________________________________________________
- Fórmula química del producto de la reacción insoluble en agua ( precipitado): ___________________________________________________________
- Fórmula química del producto de la reacción soluble en agua ________________________________________________________________________
- Escriba la ecuación química balanceada para esta reacción: _________________________________________________________________________
Justifique la coloración amarilla de la solución resultante final ( Investigue el color de los productos obtenidos ).
___________________________________________________________________
Mencione dos evidencias experimentales que lo llevan a concluir que hubo reacción entre el KI y Pb(NO3)2
a- ____________________________________________________________________
b- _______________________________________________________________________
INVESTIGUE:
¿ Qué entendemos por Oxidación ?
______________________________________________________________________
Defina Reducción:
______________________________________________________________________
¿ Qué es una reacción de Óxido – Reducción ?:
______________________________________________________________________
Explique por qué todas las reacciones de Simple desplazamiento pueden ser consideradas como reacciones de Óxido – Reducción ( REDOX ).
_____________________________________________________________________
Explique por qué las reacciones de Combustión son consideradas reacciones REDOX ?:
______________________________________________________________________
martes, 9 de marzo de 2010
DISOLUCIONES
2010 COLEGIO DE LA SALLE
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 °
Apuntes de Química 12° Tema: Las disoluciones
Mezcla: Combinación de dos o más sustancias puras.
Fase: Cada una de las partes homogéneas ( iguales ) de un sistema heterogéneo. Región de materia cuyo conjunto de propiedades son idénticas. Cada una de las partes distinguibles en una mezcla.
Mezcla Homogénea: Combinación de dos o más sustancias en donde se observa o distingue una sola fase y la composición es uniforme (Sal-Agua).
Mezcla Heterogénea: Combinación de dos o más sustancias en donde físicamente se observan más de una fase y cuya composición no es uniforme (Arena- Agua).
Disolución: Mezcla homogénea de dos o más sustancias . Está constituida por dos componentes básicos: Soluto y Solvente.
Soluto: Sustancia que se disuelve y que se encuentra presente en la solución en menor cantidad ( en gramos ).
Solvente: Sustancia que disuelve y que se encuentra presente en la solución en mayor cantidad ( en gramos ).
TIPOS DE DISOLUCIONES

Electronegatividad: Atracción que ejerce un átomo sobre los electrones que forman un enlace químico. Aumenta en los períodos de la Tabla Periódica hacia la derecha y en los grupos o familias hacia arriba. Es mayor entre más pequeños sea el átomo.
Disolver: Dispersar las moléculas o iones del soluto entre las moléculas del disolvente de manera tal que ocurra una interacción o atracción entre las moléculas del solvente y del soluto. En estas interacciones actúan las polaridades o cargas positivas – negativas de los polos de las moléculas participantes. Ésta polaridad depende de la electronegatividad de los elementos.
Tabla de Electronegatividad

Enlace iónico: Ocurre por transferencia de electrones de un átomo a otro más electronegativo. La diferencia de electronegatividad de los átomos es ≥ 1.7. Ejemplos: Na –Cl (2.1); Mg – F (2.8); Li – Br (1.8).
Estos enlaces son polares ya que existen polos positivos – negativos definidos.
Enlace Covalente: Ocurre por compartimiento de electrones entre dos átomos de parecida o igual electronegatividad. La diferencia de electronegatividad de los átomos es < 1.7. Se dividen en enlaces: Covalente polar y Covalente no polar.
Covalente Polar: Ocurre por compartimiento de electrones entre dos átomos de parecida electronegatividad. La diferencia de electronegatividad de los átomos es 0.8 – 1.6.
Estos enlaces son polares ya que existen polos positivos – negativos.
Ejemplos: H – O ( 1.4 ) H – Cl ( 0.9 ) Excepción: H – F (1.9 ) pareciera iónico pero es covalente polar, ya que el H forma siempre enlaces de tipo covalente.
Covalente No Polar: Se da por compartimiento de electrones entre dos átomos de igual o parecida electronegatividad. La diferencia de electronegatividad de los átomos es de 0.0 – 0.7 . En estos enlaces ambos átomos tienen la misma capacidad para atraer los electrones del enlace; por esta razón no se forman polos con cargas definidas sino polos transitorios.
Ejemplos: Cl – Cl ( 0 ) ; C – H ( 0.4 ) ; Br – C ( 0.3 ).
Solubilidad: Propiedad física que indica la capacidad de una sustancia de dispersarse o disolverse completa o parcialmente en otra por medio de atracciones electrostáticas.
Disolución de Sustancias iónicas:
Los iones de los compuestos iónicos ( NaCl ) al ser disueltos en H2O (covalente polar) se disocian y se separan de la red cristalina de la sal dispersándose en el solvente ; e individualmente son rodeados por las moléculas polares del agua. Éstas moléculas de agua orientan sus polos negativos ( átomos de oxígeno ) para rodear los iones positivos de la sal ( Na 1 + ), mientras que los iones negativos (Cl 1–) son rodeados por los polos o extremos positivos ( átomos de hidrógeno).
Disolución de Sustancias Covalentes Polares
Estas disoluciones se hacen mediante interacciones conocidas como “ Puentes de Hidrógeno ”.
Puentes de Hidrógeno: Interacción covalente entre el H y átomos electronegativos preferiblemente como O, N, F. Este tipo de interacción se experimenta entre las propias moléculas de agua en sus enlaces H -O.
Las sustancias covalentes polares tienen grupos moleculares similares en carga a los del agua por lo que son muy compatibles con éstas. Moléculas como la Glucosa (C6H12O6) ; Sacarosa (C12H22O11) (Azúcar de mesa); Etanol ( C2H6O ) ( Alcohol etílico ), son ejemplos de moléculas polares que forman interacciones “Puentes de Hidrógeno” con las moléculas de agua .
Las moléculas covalentes polares NO SE DISOCIAN en agua; por el contrario permanece intacta y lo que ocurre es una interacción de los polos de estas moléculas con los polos positivos o negativos del agua mediante atracciones puente de Hidrógeno.
Hay sustancias que NO son solubles en agua ya que están formados únicamente por enlaces covalentes no polares ( C – H ). Ejemplo de estas sustancias son los hidrocarburos o derivados del petróleo ( largas cadenas de C –H ) y los aceites que también son moléculas formadas por largas cadenas de C –H.
Reglas de solubilidad de las sustancias: Basados en los criterios estudiados podemos concluir con las reglas “Lo igual disuelve lo igual”. Esto se refiere a que sustancias polares de disuelven en sustancias polares y sustancias no polares se disuelven en sustancias no polares.
A continuación los siguientes criterios para estudiar la solubilidad de compuestos iónicos en agua a 25°C.
Nota: Estas reglas de solubilidad se basan en observaciones experimentales ya que NO hay regla sencilla que nos permita predecir o explicar con certeza la solubilidad de los diferentes compuestos iónicos.

Cuando empleamos solutos sólidos (Sal de cocina), su disolución en agua se expresa usando la expresión soluble o no soluble; si se trata de solutos líquidos (Alcohol ), su disolución en agua se expresa usando la expresión: Líquidos miscibles o inmiscibles.
Los líquidos son miscibles cuando los líquidos se combinan completamente en cualquier proporción para formar una solución.
Los líquidos son inmiscibles: Cuando los líquidos no se mezclan sino que forman capas separadas. Ninguno de los dos se disuelven de manera apreciable en el otro.
FACTORES QUE AFECTAN LA SOLUBILIDAD DE LAS SUSTANCIAS.
La solubilidad depende de:
1- Naturaleza Química Soluto-Solvente: Sustancias polares se disuelven en solventes polares y sustancias no polares se disuelven en solventes no polares o apolares. Regla: “Lo igual disuelve lo igual”.
2- Temperatura: La solubilidad de la mayoría de los sólidos en un líquido por lo general aumenta con la temperatura la cual facilita la cinética química y las interacciones entre soluto-solvente. A grosso modo se puede deducir la siguiente regla: “ La solubilidad de solutos sólidos generalmente es directamente proporcional a la temperatura ”.
En los sistemas Gas-Líquidos; “La solubilidad de solutos gaseosos es inversamente proporcional a la temperatura ”, es por esto que observamos el burbujeo al hervir el agua debido a los gases disueltos en esta: H2 , O2 , N2, CO2.
Aquí juega un papel relevante la densidad del gas ( masa / volumen ) que es afectada por la temperatura, siguiendo la Ley de los gases de Charles ( Volumen del gas a Temperatura ). A mayor temperatura > Volumen y por ende menor Densidad por lo que el gas es más liviano y se separa del líquido. Lo contrario ocurre si disminuye la temperatura , por lo que el gas se hace más pesado ( aumenta su densidad ) y se queda en el líquido.
3- Presión: Ésta NO afecta los sistemas Sólidos-Líquidos; sólo perturba los sistemas Gas-Líquidos. “ La solubilidad de un soluto gaseoso es directamente proporcional a la presión ”. Es por ésto que al destapar una soda la disminución de la presión en el sistema permite el escape del exceso de CO2 y se observa efervescencia.
Aquí juega también un papel importante la densidad del gas ( masa / volumen ) que es afectada por la presión, siguiendo la Ley de los gases de Boyle ( Volumen del gas 1 / a Presión ). A mayor presión < Volumen y por ende mayor Densidad por lo que el gas es más pesado y se queda en el líquido. Lo contrario ocurre si disminuye la presión , por lo que el gas se hace más liviano
( disminuye su densidad ) y se separa del líquido.
FACTORES QUE AFECTAN LA VELOCIDAD DE DISOLUCIÓN DE LAS SUSTANCIAS.
La velocidad de disolución depende de:
1- Tamaño de las partículas: Las partículas más finas o trituradas tienen mayor área de superficie expuestas al disolvente y esto facilita las interacciones entre el soluto-solvente. Se hace entonces más fácil la dispersión del soluto en el solvente.
2- Velocidad de agitación ( Agitación mecánica ): Se aumentan así las interacciones soluto-solvente debido a que el soluto no disuelto se aproxima para unirse más rápido al solvente. La agitación por ende mejora la dispersión del soluto en el solvente.
3- Temperatura: Este factor también afecta las interacciones entre las moléculas del soluto con el solvente ya que aumenta el grado de movimiento entre las moléculas del sistema. Se facilita así la dispersión del soluto en el solvente.
Concentración: Relación entre la cantidad de soluto y cantidad de solvente en una solución. Medida de la cantidad del soluto contenido en una cantidad de disolvente o solución.
La concentración de una solución se puede expresar cualitativamente y cuantitativamente.
Medición Cualitativa de la concentración de soluciones: Se basa en la apreciación que hacemos nosotros de una concentración (cantidad de soluto en un solvente) basándonos en nuestros sentidos (gusto, olfato). Esta apreciación es subjetiva y relativa; no igual para todos.
Para sistemas líquidos-líquidos, las medidas cualitativas más comunes son: Concentradas (alta cantidad de soluto) y Diluidas (baja cantidad de soluto).
Para sistemas Sólidos- líquidos, las medidas cualitativas de concentración más comunes son: Solución no saturada, Saturada, Sobresaturada.
Para referirnos a estas medidas cualitativas de expresar concentraciones es necesario considerar que sin importar lo finas o pequeñas que sean las partículas de soluto, lo caliente que esté el solvente, o lo mucho o rápido que agitemos el sistema soluto-solvente; en algún momento el solvente ya no podrá contener en sus enlaces o puntos de interacción ninguna molécula de soluto, por lo que el exceso de soluto se precipita o cristaliza y se va al fondo del recipiente porque se ha excedido la concentración máxima de soluto que puede retener el solvente. Las medida de la cantidad máxima de un soluto a determinadas temperaturas ya están estandarizadas para cada sustancia y se conocen como LÍMITES DE SOLUBILIDAD.
Equilibrio Dinámico: Estado en el que la velocidad de disolución de un soluto no disuelto es igual a la velocidad de cristalización del soluto disuelto, por lo que la cantidad neta de soluto no disuelto y disuelto en solución permanece constante. Este equilibrio se puede representar de la siguiente forma:
Soluto No disuelto Velocidad de disolución Soluto Disuelto
Velocidad de cristalización
Esta dinámica del sistema no es apreciable a nivel macro sino a nivel molecular (microscópico).
Solución No Saturada: Aquellas donde la cantidad de soluto que contiene la solución es menor que la que se puede disolver o que puede aceptar el disolvente como máximo. En ellas la Velocidad de disolución > Velocidad de cristalización del soluto.
Solución Saturada: Es aquella que contiene la cantidad máxima de soluto que puede hallarse disuelta en el disolvente.
En estas soluciones la Velocidad de disolución = Velocidad de cristalización del soluto.
Estas soluciones se encuentran en equilibrio dinámico con el soluto disuelto y el no disuelto, por lo tanto las concentraciones de éstos solutos (disuelto y no disuelto) permanecen constantes.
Solución Sobresaturada: Solución en la cual la cantidad del soluto es mayor de la que puede aceptar el disolvente como máximo. Se prepara calentando la solución a altas temperaturas para obligar a las moléculas del solvente a interactuar con el soluto y aceptarlo en disolución. Son soluciones inestables ya que al bajar la temperatura se debilitan las falsas interacciones
soluto- solvente y el soluto cristaliza o precipita. En estas soluciones la Velocidad de cristalización del soluto disuelto > Velocidad de disolución del soluto no disuelto.
PARA DESCARGAR EL DOCUMENTO
Click Aquí
PROFESOR: SADAY E. ZAPATA L. NIVEL: 12 °
Apuntes de Química 12° Tema: Las disoluciones
Mezcla: Combinación de dos o más sustancias puras.
Fase: Cada una de las partes homogéneas ( iguales ) de un sistema heterogéneo. Región de materia cuyo conjunto de propiedades son idénticas. Cada una de las partes distinguibles en una mezcla.
Mezcla Homogénea: Combinación de dos o más sustancias en donde se observa o distingue una sola fase y la composición es uniforme (Sal-Agua).
Mezcla Heterogénea: Combinación de dos o más sustancias en donde físicamente se observan más de una fase y cuya composición no es uniforme (Arena- Agua).
Disolución: Mezcla homogénea de dos o más sustancias . Está constituida por dos componentes básicos: Soluto y Solvente.
Soluto: Sustancia que se disuelve y que se encuentra presente en la solución en menor cantidad ( en gramos ).
Solvente: Sustancia que disuelve y que se encuentra presente en la solución en mayor cantidad ( en gramos ).
TIPOS DE DISOLUCIONES

Electronegatividad: Atracción que ejerce un átomo sobre los electrones que forman un enlace químico. Aumenta en los períodos de la Tabla Periódica hacia la derecha y en los grupos o familias hacia arriba. Es mayor entre más pequeños sea el átomo.
Disolver: Dispersar las moléculas o iones del soluto entre las moléculas del disolvente de manera tal que ocurra una interacción o atracción entre las moléculas del solvente y del soluto. En estas interacciones actúan las polaridades o cargas positivas – negativas de los polos de las moléculas participantes. Ésta polaridad depende de la electronegatividad de los elementos.
Tabla de Electronegatividad

Enlace iónico: Ocurre por transferencia de electrones de un átomo a otro más electronegativo. La diferencia de electronegatividad de los átomos es ≥ 1.7. Ejemplos: Na –Cl (2.1); Mg – F (2.8); Li – Br (1.8).
Estos enlaces son polares ya que existen polos positivos – negativos definidos.
Enlace Covalente: Ocurre por compartimiento de electrones entre dos átomos de parecida o igual electronegatividad. La diferencia de electronegatividad de los átomos es < 1.7. Se dividen en enlaces: Covalente polar y Covalente no polar.
Covalente Polar: Ocurre por compartimiento de electrones entre dos átomos de parecida electronegatividad. La diferencia de electronegatividad de los átomos es 0.8 – 1.6.
Estos enlaces son polares ya que existen polos positivos – negativos.
Ejemplos: H – O ( 1.4 ) H – Cl ( 0.9 ) Excepción: H – F (1.9 ) pareciera iónico pero es covalente polar, ya que el H forma siempre enlaces de tipo covalente.
Covalente No Polar: Se da por compartimiento de electrones entre dos átomos de igual o parecida electronegatividad. La diferencia de electronegatividad de los átomos es de 0.0 – 0.7 . En estos enlaces ambos átomos tienen la misma capacidad para atraer los electrones del enlace; por esta razón no se forman polos con cargas definidas sino polos transitorios.
Ejemplos: Cl – Cl ( 0 ) ; C – H ( 0.4 ) ; Br – C ( 0.3 ).
Solubilidad: Propiedad física que indica la capacidad de una sustancia de dispersarse o disolverse completa o parcialmente en otra por medio de atracciones electrostáticas.
Disolución de Sustancias iónicas:
Los iones de los compuestos iónicos ( NaCl ) al ser disueltos en H2O (covalente polar) se disocian y se separan de la red cristalina de la sal dispersándose en el solvente ; e individualmente son rodeados por las moléculas polares del agua. Éstas moléculas de agua orientan sus polos negativos ( átomos de oxígeno ) para rodear los iones positivos de la sal ( Na 1 + ), mientras que los iones negativos (Cl 1–) son rodeados por los polos o extremos positivos ( átomos de hidrógeno).
Disolución de Sustancias Covalentes Polares
Estas disoluciones se hacen mediante interacciones conocidas como “ Puentes de Hidrógeno ”.
Puentes de Hidrógeno: Interacción covalente entre el H y átomos electronegativos preferiblemente como O, N, F. Este tipo de interacción se experimenta entre las propias moléculas de agua en sus enlaces H -O.
Las sustancias covalentes polares tienen grupos moleculares similares en carga a los del agua por lo que son muy compatibles con éstas. Moléculas como la Glucosa (C6H12O6) ; Sacarosa (C12H22O11) (Azúcar de mesa); Etanol ( C2H6O ) ( Alcohol etílico ), son ejemplos de moléculas polares que forman interacciones “Puentes de Hidrógeno” con las moléculas de agua .
Las moléculas covalentes polares NO SE DISOCIAN en agua; por el contrario permanece intacta y lo que ocurre es una interacción de los polos de estas moléculas con los polos positivos o negativos del agua mediante atracciones puente de Hidrógeno.
Hay sustancias que NO son solubles en agua ya que están formados únicamente por enlaces covalentes no polares ( C – H ). Ejemplo de estas sustancias son los hidrocarburos o derivados del petróleo ( largas cadenas de C –H ) y los aceites que también son moléculas formadas por largas cadenas de C –H.
Reglas de solubilidad de las sustancias: Basados en los criterios estudiados podemos concluir con las reglas “Lo igual disuelve lo igual”. Esto se refiere a que sustancias polares de disuelven en sustancias polares y sustancias no polares se disuelven en sustancias no polares.
A continuación los siguientes criterios para estudiar la solubilidad de compuestos iónicos en agua a 25°C.
Nota: Estas reglas de solubilidad se basan en observaciones experimentales ya que NO hay regla sencilla que nos permita predecir o explicar con certeza la solubilidad de los diferentes compuestos iónicos.

Cuando empleamos solutos sólidos (Sal de cocina), su disolución en agua se expresa usando la expresión soluble o no soluble; si se trata de solutos líquidos (Alcohol ), su disolución en agua se expresa usando la expresión: Líquidos miscibles o inmiscibles.
Los líquidos son miscibles cuando los líquidos se combinan completamente en cualquier proporción para formar una solución.
Los líquidos son inmiscibles: Cuando los líquidos no se mezclan sino que forman capas separadas. Ninguno de los dos se disuelven de manera apreciable en el otro.
FACTORES QUE AFECTAN LA SOLUBILIDAD DE LAS SUSTANCIAS.
La solubilidad depende de:
1- Naturaleza Química Soluto-Solvente: Sustancias polares se disuelven en solventes polares y sustancias no polares se disuelven en solventes no polares o apolares. Regla: “Lo igual disuelve lo igual”.
2- Temperatura: La solubilidad de la mayoría de los sólidos en un líquido por lo general aumenta con la temperatura la cual facilita la cinética química y las interacciones entre soluto-solvente. A grosso modo se puede deducir la siguiente regla: “ La solubilidad de solutos sólidos generalmente es directamente proporcional a la temperatura ”.
En los sistemas Gas-Líquidos; “La solubilidad de solutos gaseosos es inversamente proporcional a la temperatura ”, es por esto que observamos el burbujeo al hervir el agua debido a los gases disueltos en esta: H2 , O2 , N2, CO2.
Aquí juega un papel relevante la densidad del gas ( masa / volumen ) que es afectada por la temperatura, siguiendo la Ley de los gases de Charles ( Volumen del gas a Temperatura ). A mayor temperatura > Volumen y por ende menor Densidad por lo que el gas es más liviano y se separa del líquido. Lo contrario ocurre si disminuye la temperatura , por lo que el gas se hace más pesado ( aumenta su densidad ) y se queda en el líquido.
3- Presión: Ésta NO afecta los sistemas Sólidos-Líquidos; sólo perturba los sistemas Gas-Líquidos. “ La solubilidad de un soluto gaseoso es directamente proporcional a la presión ”. Es por ésto que al destapar una soda la disminución de la presión en el sistema permite el escape del exceso de CO2 y se observa efervescencia.
Aquí juega también un papel importante la densidad del gas ( masa / volumen ) que es afectada por la presión, siguiendo la Ley de los gases de Boyle ( Volumen del gas 1 / a Presión ). A mayor presión < Volumen y por ende mayor Densidad por lo que el gas es más pesado y se queda en el líquido. Lo contrario ocurre si disminuye la presión , por lo que el gas se hace más liviano
( disminuye su densidad ) y se separa del líquido.
FACTORES QUE AFECTAN LA VELOCIDAD DE DISOLUCIÓN DE LAS SUSTANCIAS.
La velocidad de disolución depende de:
1- Tamaño de las partículas: Las partículas más finas o trituradas tienen mayor área de superficie expuestas al disolvente y esto facilita las interacciones entre el soluto-solvente. Se hace entonces más fácil la dispersión del soluto en el solvente.
2- Velocidad de agitación ( Agitación mecánica ): Se aumentan así las interacciones soluto-solvente debido a que el soluto no disuelto se aproxima para unirse más rápido al solvente. La agitación por ende mejora la dispersión del soluto en el solvente.
3- Temperatura: Este factor también afecta las interacciones entre las moléculas del soluto con el solvente ya que aumenta el grado de movimiento entre las moléculas del sistema. Se facilita así la dispersión del soluto en el solvente.
Concentración: Relación entre la cantidad de soluto y cantidad de solvente en una solución. Medida de la cantidad del soluto contenido en una cantidad de disolvente o solución.
La concentración de una solución se puede expresar cualitativamente y cuantitativamente.
Medición Cualitativa de la concentración de soluciones: Se basa en la apreciación que hacemos nosotros de una concentración (cantidad de soluto en un solvente) basándonos en nuestros sentidos (gusto, olfato). Esta apreciación es subjetiva y relativa; no igual para todos.
Para sistemas líquidos-líquidos, las medidas cualitativas más comunes son: Concentradas (alta cantidad de soluto) y Diluidas (baja cantidad de soluto).
Para sistemas Sólidos- líquidos, las medidas cualitativas de concentración más comunes son: Solución no saturada, Saturada, Sobresaturada.
Para referirnos a estas medidas cualitativas de expresar concentraciones es necesario considerar que sin importar lo finas o pequeñas que sean las partículas de soluto, lo caliente que esté el solvente, o lo mucho o rápido que agitemos el sistema soluto-solvente; en algún momento el solvente ya no podrá contener en sus enlaces o puntos de interacción ninguna molécula de soluto, por lo que el exceso de soluto se precipita o cristaliza y se va al fondo del recipiente porque se ha excedido la concentración máxima de soluto que puede retener el solvente. Las medida de la cantidad máxima de un soluto a determinadas temperaturas ya están estandarizadas para cada sustancia y se conocen como LÍMITES DE SOLUBILIDAD.
Equilibrio Dinámico: Estado en el que la velocidad de disolución de un soluto no disuelto es igual a la velocidad de cristalización del soluto disuelto, por lo que la cantidad neta de soluto no disuelto y disuelto en solución permanece constante. Este equilibrio se puede representar de la siguiente forma:
Soluto No disuelto Velocidad de disolución Soluto Disuelto
Velocidad de cristalización
Esta dinámica del sistema no es apreciable a nivel macro sino a nivel molecular (microscópico).
Solución No Saturada: Aquellas donde la cantidad de soluto que contiene la solución es menor que la que se puede disolver o que puede aceptar el disolvente como máximo. En ellas la Velocidad de disolución > Velocidad de cristalización del soluto.
Solución Saturada: Es aquella que contiene la cantidad máxima de soluto que puede hallarse disuelta en el disolvente.
En estas soluciones la Velocidad de disolución = Velocidad de cristalización del soluto.
Estas soluciones se encuentran en equilibrio dinámico con el soluto disuelto y el no disuelto, por lo tanto las concentraciones de éstos solutos (disuelto y no disuelto) permanecen constantes.
Solución Sobresaturada: Solución en la cual la cantidad del soluto es mayor de la que puede aceptar el disolvente como máximo. Se prepara calentando la solución a altas temperaturas para obligar a las moléculas del solvente a interactuar con el soluto y aceptarlo en disolución. Son soluciones inestables ya que al bajar la temperatura se debilitan las falsas interacciones
soluto- solvente y el soluto cristaliza o precipita. En estas soluciones la Velocidad de cristalización del soluto disuelto > Velocidad de disolución del soluto no disuelto.
PARA DESCARGAR EL DOCUMENTO
Click Aquí
Suscribirse a:
Entradas (Atom)